Майкл Палмер, доктор медицины, Сухарит Бхакди, доктор медицины, и Вольфганг Водарг, доктор медицины
Это экспертное заключение было представлено консорциумом юристов в Конституционный суд Южной Африки в связи с иском, оспаривающим меры правительства по COVID. Подобные документы были опубликованы ранее D4CE относительно вакцины Pfizer [ 1 ] и вакцины Moderna [ 2 ] .
Настоящим дается разрешение на свободное совместное использование и распространение этого документа в неизменном виде.
Скачать PDF-файл здесь
Оригинал на английском:
1. Предыстория и введение
В этом экспертном заключении обсуждаются безопасность и эффективность вакцины Ad26.COV2.S на основе аденовируса компании Johnson & Johnson (J & J’s) против COVID-19 (вакцина J & J). Это относится к открытому отчету Европейского агентства по лекарственным средствам (EMA) об оценке этой вакцины, а также к рецензируемым научным публикациям и нескольким другим источникам данных. Отчет EMA [ 3 ] используется в качестве основного справочного материала, поскольку он является наиболее подробным документом в своем роде. Аналогичный, но более короткий документ был подготовлен Американским управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в связи с разрешением FDA на экстренное использование вакцины J & J [ 4 ] .. Большинство других регулирующих органов, включая, в частности, Управление по регулированию товаров медицинского назначения Южной Африки (SAHPRA), не публиковали подобных подробных документов.
1.1. Вакцина J & J — это не традиционная вакцина, а форма генной терапии.
В принципе, использование слова «вакцина» для вакцины J & J вводит в заблуждение и способствует неоправданным ожиданиям в общественном сознании защитного эффекта с низким риском. Согласно научному определению, метод, используемый этой вакциной, а именно введение ДНК в клетки человека, представляет собой генную терапию, и поэтому вакцина J & J является продуктом генной терапии. Эта точка зрения принята FDA в кратком руководстве «Что такое генная терапия?» [ 5 ] :
Генная терапия может работать по нескольким механизмам: … введение в организм нового или модифицированного гена для лечения болезни
В определении FDA также прямо упоминается использование вирусных векторов как одного из методов введения чужеродной ДНК:
Вирусные векторы: Вирусы обладают естественной способностью доставлять генетический материал в клетки, поэтому некоторые продукты генной терапии получают из вирусов. Как только вирусы были модифицированы для устранения их способности вызывать инфекционные заболевания, эти модифицированные вирусы можно использовать в качестве векторов (носителей) для переноса терапевтических генов в клетки человека.
Это определение FDA описывает вакцину J & J как «T». В этом случае модифицированный аденовирус используется в качестве вектора (носителя) для переноса чужеродного синтетического генетического материала (ДНК) в клетки человека. Эта чужеродная ДНК кодирует спайковый белок SARS-CoV-2, заставляя клетки синтезировать этот белок.
1.2. Система доставки генов, используемая в вакцине J & J, вызывает риск отсроченного тяжелого заболевания.
Кроме того, введение в клетки человека этой чужеродной ДНК повышает вероятность ее стабильного необратимого включения в геном человека. Это, в свою очередь, создает потенциал для опасных побочных эффектов, некоторые из которых могут быть подтверждены или исключены только при длительном наблюдении. Эти побочные эффекты необходимо учитывать при использовании любого такого продукта генной терапии, но в случае с этой вакциной они даже не были исследованы в самом предварительном порядке — в настоящее время не проводятся какие-либо долгосрочные исследования.
Поэтому неуместно называть вакцину J & J защитной вакциной в классическом стиле. Для простоты, а также для согласованности этого экспертного мнения с первоначальным отчетом EMA в дальнейшем будет использоваться термин «вакцина». Тем не менее, читатель должен иметь в виду, что этот инъекционный препарат является не настоящей вакциной, а продуктом генной терапии, который может необратимо изменить клетки человека.
2. Состав вакцины J & J
2.1. Рекомбинантная конструкция аденовируса
Аденовирусы представляют собой неинкапсулированные икосаэдрические инфекционные частицы (вирионы) диаметром от 80 до 100 нм. Каждый вирион содержит одну копию генома двухцепочечной ДНК.
Активное вещество вакцины J & J состоит из рекомбинантного аденовируса человека типа 26, который содержит синтетический ген, кодирующий спайковый гликопротеин SARS-CoV-2. Этот ген был оптимизирован по кодонам для повышения эффективности синтеза белка в клетках человека, а также содержит несколько аминокислотных замен, которые стабилизируют структуру белка. В частности, сайт узнавания протеазы фурина, которая расщепляет шиповидный белок на его фрагменты S1 и S2 внутри клетки-хозяина, был упразднен путем замены нескольких важных аминокислот. Кроме того, два остатка пролина были введены в шарнирную область шиповидного белка; это приводит к тому, что спайковый белок остается в так называемой
конформации «prefusion» [ 3 ] (стр. 43).
После того, как этот модифицированный вирус заражает клетку, каждый ген измененного вирусного генома транскрибируется в информационную РНК (мРНК), которая затем транслируется в кодируемую белковую молекулу с помощью клеточных рибосом. Трансляция спайкового белка SARS-CoV-2 начинается с формирования лидерной последовательности. Эта лидерная последовательность заставляет спайковый белок входить в секреторный путь клетки и в конечном итоге включаться в клеточную мембрану и подвергаться воздействию других клеток. Некоторые молекулы спайкового белка останутся на клетке, что может привести к ее атаке со стороны иммунной системы (см. Раздел 6.8.2 ); другие молекулы шиповидного белка могут подвергаться расщеплению, а отщепленные фрагменты S1 могут связываться с рецепторами на других клетках, вызывая повреждение последних (см. Раздел 6.8.1 ).
2.2. Вирус вакцины J&J дефицитен по репликации
Геном вакцинного вируса J&J не только снабжен синтетическим шиповидным белком SARS-CoV-2, но и был модифицирован таким образом, чтобы вирионы, оставаясь способными проникать в клетки человека и инициировать синтез вируса белки, не могут образовывать функциональные вирионы-потомки, которые могли бы, в свою очередь, инфицировать другие клетки. В принципе, это должно предотвратить распространение вакцинного вируса среди населения.
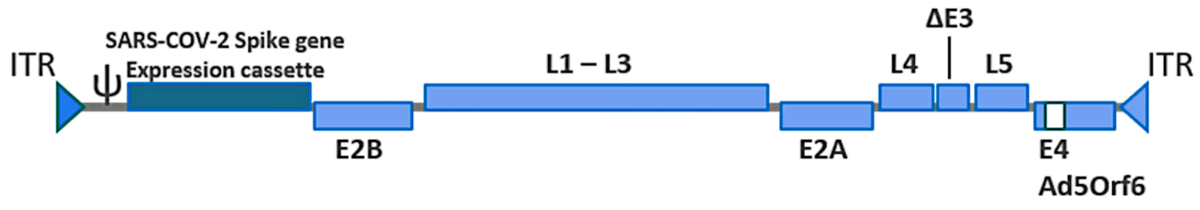
Для достижения этой цели был удален ген Е1, кодирующий существенную часть белковой оболочки вируса (капсид). Место, освобожденное этой делецией, было заполнено геном, кодирующим модифицированный спайковый белок SARS-CoV-2 (см. Рисунок 1 ). Поскольку белок Е1 по-прежнему необходим для создания частиц вакцинного вируса, кодирующий его ген был встроен в геном клеточной линии (PER.C6 TetR), которая используется для производства вакцины.
Дальнейшая оптимизация касается экспрессии шиповидного белка SARS-CoV-2, который включается в клетках вакцинированных людей, но подавляется в продуцирующей клеточной линии, освобождая последнюю от значительного биосинтетического бремени. Это достигается помещением гена спайкового белка под контроль высокоэффективного промотора (длинный цитомегаловирус, регулируемый тетрациклином человека, CMV), который содержит сайты связывания белка-репрессора Tet. Транскрипция шиповидного белка в основном подавляется, когда присутствует белок-репрессор Tet, как это происходит в клеточной линии PER.C6 TetR. Однако белок-репрессор отсутствует в клетках человека, что означает включение транскрипции.
Рекомбинантный вирусный геном содержит несколько других незначительных модификаций, которые суммированы
в отчете EMA [ 3 ] (стр. 43).
2.3. Другие ингридиенты
Помимо только что описанных вирусных частиц, вакцина также содержит следующие ингредиенты: 2-гидроксипропил-β-циклодекстрин (ГБЦД), моногидрат лимонной кислоты, этанол, соляную кислоту, полисорбат-80, хлорид натрия, гидроксид натрия, тринатрийцитрат дигидрат, и вода для инъекций.
3. Доза и способ вакцинации
Вакцину вводят внутримышечно (в/м) в разовой дозе 5×10 10 вирусных частиц на дозу 0,5 мл. Продукт доступен в многодозовых флаконах объемом 2,5 мл (5 доз) в упаковках по 10 флаконов [ 3 ] (стр. 19).
4. Производство вакцины J & J
4.1. Производственные площадки
Существуют три предприятия по производству вакцины J & J (Janssen Vaccines & Prevention BV, Лейден, Нидерланды; Janssen Biologics BV, Лейден, Нидерланды; Emergent Manufacturing Operations Baltimore LLC, Балтимор, США). Сертификаты соответствия надлежащей производственной практике (GMP) доступны для всех предприятий [ 3 ] (стр. 21-22).
4.2. Производственный процесс
Описание производственного процесса, приведенное в отчете EMA, неясно. В тексте описывается, что вирусная рекомбинантная ДНК была взята из вирусов, ранее продуцируемых в клетках. Авторы описывают, как они разрушают эти клетки, а затем выделяют вирусы из клеточного лизата. Однако вирусные частицы выделяют не из клеточных лизатов, а скорее из (жидкой) питательной среды. Однако далее в отчете авторы упоминают, какие вещества они добавили в процесс ферментации в бактериальных клетках. Эти два утверждения противоречат друг другу.
Обычной практикой является производство больших количеств рекомбинантной вирусной ДНК в бактериях с использованием биореакторов. После лизиса бактериальных клеток их хромосомная ДНК расщепляется с помощью нуклеаз, и рекомбинантная вирусная ДНК (действующее вещество) отделяется от этой деградированной бактериальной ДНК и от других связанных с процессом примесей. Можно предположить, что это было сделано и здесь, так как в конце авторы упоминают, что рекомбинантная ДНК проходит через фильтры с порами 0,2 мкм, чтобы удалить любые оставшиеся бактериальные клетки или дебрис перед хранением при -40 ∘ C. Что такое элементарная ошибка в документации должна была быть допущена или пропущена EMA, вызывает серьезные сомнения в честности процесса проверки и утверждения.
После выделения из бактерий вирусная ДНК вводится (трансфицируется) в клетки PER.C6 Tet, которые затем экспрессируют из нее вирусные белки. Некоторые из этих белков соединяются с ДНК, образуя готовые вирусные частицы, которые затем высвобождаются из клеток в питательную среду. Полученные вирионы окончательно изолируют от среды.
По данным EMA, риск заражения посторонними инфекционными агентами (вирусами или другими микробами) отсутствует.
4.3. Валидация анализа репликационно-компетентных аденовирусных частиц
Хотя в принципе конструкция рекомбинантного вируса вакцины J & J делает вирионы, генерируемые клеточной культурой, неспособными к репликации in vivo, существует вероятность рекомбинации в клеточной культуре, которая может мобилизовать ген, кодирующий вирусный белок E1, из клеточной геном и вставить его в геном вируса. Это привело бы к появлению способного к репликации аденовируса (RCA). Такой вирус может затем вызывать инфекцию у вакцинированных лиц, а также потенциально передаваться и распространяться среди населения.
Проверка безопасности на отсутствие такого способного к репликации аденовируса (RCA) проводилась только для активного вещества (рекомбинантных вирионов), но не для готового фармацевтического продукта. В отчете EMA говорится, что «результаты соответствуют спецификациям критериев приемки», но эти критерии не указываются. В отчете не говорится об отсутствии частиц RCA; предположительно, они присутствовали в малом количестве. Тем не менее, присутствие любого RCA в вакцинном продукте повышает вероятность размножения аденовируса и обострения реакции хозяина.
Поскольку полностью избежать появления RCA в продуктах аденовирусного вектора в текущем производственном процессе чрезвычайно сложно, важно исследовать уровень RCA в каждой партии продукта аденовирусного вектора. Из отчета EMA неясно, применяется ли этот тест к каждой производственной партии вакцины. Кроме того, тестирование на наличие RCA у пациентов, которым вводили аденовирусные векторы, должно было быть обязательным во время клинического исследования. Последнее сделано не было [ 3 ] (стр. 33, 53).
4.4. Отсутствие испытаний на животных на случайные агенты
Поскольку вакцина J & J производится из биологических материалов, необходимо предохраняться от возможного заражения посторонними патогенными агентами. Всемирная организация здравоохранения (ВОЗ) определяет случайные агенты как микроорганизмы, которые могли быть непреднамеренно введены в процесс производства биофармацевтического продукта [ 6 ] . Эти агенты могут включать бактерии, грибки, микоплазму/спироплазму, микобактерии, риккетсии, простейших, паразитов, возбудителей трансмиссивной губчатой энцефалопатии (ТГЭ) (прионы) и вирусы.
Случайные патогены могут быть непреднамеренно введены в вакцину с исходными материалами, используемыми для производства. В то время как любой процесс производства вакцины будет включать некоторые этапы очистки, в случае живых вирусных вакцин такие процедуры обязательно должны быть достаточно щадящими и не могут гарантировать полное и надежное уничтожение всех других живых микробов. Поэтому, чтобы убедиться в отсутствии побочных агентов, необходимы обширные испытания во время производства вакцины не только in vitro, но и на животных моделях.
Предшествующий опыт показывает, что при производстве биологических продуктов к этой опасности следует относиться очень серьезно. В ряде случаев случайные агенты оставались незамеченными во время производства и попадали в продаваемый вакцинный продукт. Примерами таких загрязнителей являются обезьяний вирус SV40, обнаруженный в вакцине против полиомиелита; бактериофаги, обнаруженные в вакцинах против кори и полиомиелита; активность обратной транскриптазы, возникшая в результате контаминации неопознанным птичьим ретровирусом в вакцине против кори, эпидемического паротита и краснухи (MMR); и, наконец, частицы свиного цирковируса или последовательности ДНК, которые были обнаружены в ротавирусной вакцине [ 7 ] .
Что касается вакцины J & J, в отчете EMA цитируются многочисленные документы, касающиеся качества сырья и наполнителей, и описываются различные промежуточные этапы очистки. В нем также обсуждаются некоторые тесты, проведенные на культурах клеток [ 3 ] (стр. 37). Однако важно отметить, что отчет не содержит никакой информации об экспериментах на животных для проверки на случайные агенты. Поэтому мы должны предположить, что при производстве вакцины J & J такие испытания на животных не проводились. Эти тесты жизненно важны для защиты здоровья человека, и поэтому недопустимо игнорировать важные тесты на животных.
4.5. Спецификация стабильности и срока годности активного вещества
До тех пор, пока не было предоставлено условное одобрение, J & J не предоставила EMA данных, которые продемонстрировали бы эффективность текущих доз вакцины или приемлемую иммуногенность коммерческих серий в конце их срока годности [ 3 ] (стр. 28). .
Компания J & J провела оценку репрезентативных партий активного вещества на стабильность при хранении (в режиме реального времени при -60 ° С и в ускоренном режиме при 5 ° С). К ним относятся клинические и мелкосерийные производственные партии с предприятия Janssen Vaccine and Prevention BV (Лейден, Нидерланды) и крупные партии с предприятия Janssen Biologics BV (Лейден, Нидерланды). Была создана программа тестирования стабильности с соответствующими параметрами считывания. Все партии проверяют во все моменты времени на рН, инфекционные единицы, экспрессию трансгена, вирусные частицы и соотношение вирусных частиц к инфекционной единице.
Важно, однако, то, что на момент утверждения EMA располагала данными о стабильности только за 6 месяцев для активного вещества и за 3 месяца для небольшой коммерческой партии (производимой на предприятии Janssen Vaccine and Prevention BV), а также для крупной коммерческой партии. партия (производится на предприятии Janssen Biologics BV). Недопустимо, чтобы исследования как в режиме реального времени, так и в условиях ускоренного хранения стабильности не были завершены, а данные по всем сериям, особенно коммерческим, не были представлены до получения разрешения. При отсутствии каких-либо результатов исследований произвольно оговаривались соответствующие сроки годности продукта и условия хранения. Срок годности оценивали от длительного (ниже -40 ∘ C) и ускоренного (2-8 ∘C) данные о стабильности других вакцин на основе вирусных векторов Ad26, которые были получены с использованием той же технологической платформы.
Безответственно соглашаться с неопределенностью срока годности партии, поскольку EMA или другие регулирующие органы не могут знать, как долго будет использоваться каждая партия. Очевидно, что продолжительное хранение может снизить концентрацию инфекционных вирусных частиц до такой степени, что вакцинация приведет к слабому иммунному ответу или его отсутствию.
4.6. Стабильность готового вакцинного продукта
Время выдержки готовой вакцины, то есть период времени, в течение которого вакцина может храниться и использоваться без потери инфекционности, в настоящее время все еще определяется, поскольку вакцина просто слишком нова для наблюдения за полным течением времени потери. активности; в настоящее время доступны только некоторые ранние сроки исследований стабильности вакцины J & J на клинических партиях. Таким образом, используемое в настоящее время предварительное значение срока годности основано на статистической модели и данных по аналогичным продуктам Ad26, а не по этой конкретной вакцине.
Как только максимальное время выдержки будет подтверждено экспериментально, его необходимо сравнить с предполагаемым предварительным значением, на котором основано использование вакцины в текущей кампании вакцинации. Чем короче допустимое время удержания, тем более нестабильным является вирус.
Основываясь на приведенной выше статистической модели, используемой для прогнозирования динамики снижения эффективности вакцины, было предварительно согласовано, что невскрытые флаконы с вакциной можно хранить в течение 24 месяцев при температуре от -25 ° C до -15 ° C и 3 месяца в холодильнике при температуре 2 от ∘ C до 8 ∘ C, в обоих случаях в защищенном от света месте [ 3 ] (стр. 35).
Чувствительность готового продукта вакцины J & J к световому стрессу не определялась, и ее необходимо будет исследовать отдельно с помощью дальнейшего исследования после утверждения. В этом исследовании вакцину следует проверить на активность, мутность, радиус и агрегацию. Обо всех случаях значительного отрицательного отклонения следует немедленно сообщать в EMA.
Проверка времени выдержки важна для обеспечения постоянной инфекционности вирусных частиц. Снижение инфекционности уменьшит клеточное поглощение вакцины, что, в свою очередь, вызовет снижение выработки спайкового белка, что приведет к слабому иммунному ответу или его отсутствию. В этом случае доза вакцины не будет иметь никакого эффекта. На момент утверждения не было проверенных данных о времени удержания.
4.7. Химические и биохимические примеси
Принципы управления рисками для качества (ICH Q9) использовались для выявления критических примесей, связанных с технологическим процессом. Согласно отчету EMA, в активном веществе содержалась 81 различная примесь, только две из которых были классифицированы как критические: ДНК клетки-хозяина и белок клетки-хозяина [ 3 ] (стр. 36). J&J установила определенные пределы спецификации, соответствие которым они проверяют в процессе производства. Согласно EMA, настоящие данные показывают, что определенные этапы очистки привели к эффективной минимизации, но не устранению примесей. EMA сочла достигнутую степень чистоты достаточной.
4.7.1. Примеси, связанные с продуктом
К ним относятся пустые или неполные аденовирусные частицы, не содержащие никакой ДНК, агрегированные частицы и белковые молекулы аденовируса, а также их фрагменты или посттрансляционно модифицированные формы. Такие примеси были проанализированы J&J и переданы в EMA. Последний определил, что примеси присутствовали в небольших количествах и были постоянными между партиями. Указанные примеси присутствовали в продукте, который использовался в клинических испытаниях.
4.7.2. Элементарные примеси
Международный совет по гармонизации, членом-основателем которого является Европейское сообщество и в который SAHPRA входит в качестве наблюдателя, выпустил руководство ICH Q3D по элементарным примесям в фармацевтических продуктах. Поэтому как европейские, так и южноафриканские регулирующие органы должны потребовать, чтобы J & J обеспечила соответствие своей вакцины этому руководству. Следует разработать сводку этой оценки риска и стратегию контроля элементарных примесей в соответствии с ICH Q3D. Однако данные об элементных примесях собираются и анализируются только после утверждения. Это неприемлемо.
5. Неклинические аспекты
5.1. Исследования на животных по эффективности вакцины у животных
Исследования проводились на нескольких животных моделях [ 3 ] (стр. 44-50): 1. на мышах [ 8 ]; 2. сирийский хомяк [ 9 , 10 ]; 3. Пробные исследования на макаках -резусах [ 9 ] Эти исследования подытожены ниже.
5.1.1. Исследования на мышах
Исследование 9346-20004
- Мышам в возрасте 8-12 недель вводили однократную дозу вакцины J&J, которая содержала 10 8 , 10 9 или 10 10 вирусных частиц соответственно.
- Анализ проводили через 4 недели после вакцинации.
- Были обнаружены антитела, которые специфически связывались с шиповидным белком, и их количество (титры). антител коррелирует с дозой введенной вакцины.
- Полученные антитела обладали нейтрализующей активностью в отношении вируса SARS-CoV-2 дикого типа.
- Авторы сравнили две дозы вакцины J и J (10 8 и 10 10 вирусных частиц соответственно) и выявили Т-клетки, продуцирующие IFN-γ. Различий между двумя дозами не наблюдалось.
Исследование 9346-20007
- Использовали однократную дозу вакцины J & J (10 10 вирусных частиц, 20% дозы для человека). Это сравнивали с однократной дозой очищенного 50 мкг шиповидного белка, используемого в сочетании с мкг Adjuphos (адъювант вакцины на основе фосфата алюминия).
- Иммуногенность двух схем сравнивали через две недели после вакцинации.
- Было показано, что вакцина J & J индуцирует ассоциированный с Т-клетками цитокин IFN-γ , тогда как шиповидный белок с адъювантом из квасцов этого не делает.
- Соотношения IFN-γ/IL-4, IFN-γ/IL-5 и IFN-γ/IL-10 были высокими при использовании вакцины J & J, что указывает на ответ Th1.
- Высокие уровни IgG 2a наблюдались только после вакцинации вакциной J & J, что в отчете EMA интерпретируется как еще одно указание на Th1-направленный ответ.
5.1.2. Кролики (исследование TOX14369)
- Согласно EMA, иммунизация дозой, соответствующей одной десятой полной дозы для человека, вызывала гуморальный и клеточный иммунный ответ.
- Необработанные данные не были доступны для EMA.
5.1.3. сирийский хомяк
Исследование ТКО707
- Использовали сирийских хомяков в возрасте 10-12 недель.
- Иммуногенность и защиту вакцины J & J сравнивали с другими вакцинами-кандидатами SARS-CoV-2 на основе Ad26 и с плацебо (векторный вирус Ad26, не содержащий гена спайкового белка).
- Сравнивали одно- и двухдозовые режимы.
- Животных заражали (экспериментально заражали SARS-CoV-2) через 4 недели после последней вакцинации и наблюдали в течение 4 дней после заражения.
- Однократная иммунизация 10 9 или 10 10 частиц вакцинного вируса J и J — 2% или 20%, соответственно, от дозы для человека — индуцировала антитела, связывающие шиповидный белок, дозонезависимым образом. Титры нейтрализующих антител были выше через 4 недели после второй дозы, чем через 4 недели после однократной дозы. Мы отмечаем, что этот экспериментальный дизайн не доказывает, что бустерная доза увеличивает ответ антител. Титр антител мог увеличиваться со временем даже без второй дозы вакцины; следовательно, титры антител следует измерять и сравнивать в одни и те же моменты времени после первой инъекции у животных, которые получали и не получали вторую дозу соответственно.
- Иммунизация вакциной J & J снизила вирусную нагрузку в легких после заражения вирусом SARS-CoV-2 по сравнению с плацебо. Однако снижение вирусной нагрузки не было очевидным в верхних дыхательных путях, поскольку инфекционные частицы вируса также обнаруживались у вакцинированных животных после контрольного заражения. Это произошло независимо от схемы однократной или двукратной вакцинации.
- Из-за технической ошибки доступны только ограниченные гистопатологические данные для однодозового режима, что затрудняет вывод о потенциальных преимуществах двухдозового режима (необработанные данные недоступны).
Исследование ТКО766
- Иммуногенность и эффективность вакцины J&J в однократном режиме определяли на сирийских хомячках при различных дозах 10 7 , 10 8 , 10 9 или 10 10 вирусных частиц вакцины J&J, при этом наибольшая доза соответствовала до 20% дозы для человека.
- Плацебо состояло из 10 10 вирусных частиц вектора Ad26, не кодирующего антиген SARS-CoV-2.
- Вирусную нагрузку и гистопатологию легких оценивали после заражения.
- Однократная иммунизация вакциной J & J индуцировала выброс антител, связывающих белок и нейтрализующих антител, и снижала медианную вирусную нагрузку в легких, а также более низкие показатели гистопатологии дыхательных путей после инокуляции SARS-CoV-2. Все эффекты были дозозависимыми.
- Доза 10 8 вирусных частиц или менее вакцины J&J приводила к прорыву инфекции SARS-CoV-2 при контрольном заражении, что определялось вирусной нагрузкой в легочной ткани. В случае прорыва инфекции повышения вирусной нагрузки по сравнению с инфекцией в контрольной группе не отмечалось. Не было признаков повышенной патологии легких у вакцинированных животных даже при более низких дозах, и в гистопатологических анализах не было отмечено присутствия эозинофилов, что свидетельствует о том, что наличие низких уровней нейтрализующих антител, вызванных субоптимальными дозами вакцины J & J вакцины не усугубляют заболевание легких у инфицированных сирийских хомяков по сравнению с контрольной группой.
Тостаноски и др. [ 11 ] :
- Однократное введение 2 % (10 9 вирусных частиц) или 20 % (10 10 вирусных частиц) дозы вакцины J&J для человека защищает сирийских хомяков от тяжелых заболеваний и смертности после заражения высокой дозой 5 × 10 5 TCID 50 (средняя инфекционная доза культуры ткани).
- У вакцинированных животных наблюдалась минимальная интерстициальная пневмония, тогда как у контрольных животных наблюдалась мультифокальная пневмония средней и тяжелой степени, характеризующаяся консолидацией, поражающая от 30 до 60% паренхимы легких.
- Реакции антител обратно коррелируют с вирусной нагрузкой в легких после заражения.
- В этой модели также была выявлена обратная корреляция ответа антител с
вирусной нагрузкой верхних дыхательных путей. - Иммунизация вакциной J & J уменьшала количество копий РНК вируса и период времени их персистенции в легких, носу, трахее, сердце, желудочно-кишечном тракте, головном мозге, селезенке, печени и почках по сравнению с ложновакцинированными животными.
На основании данных, представленных в исследованиях иммуногенности и контрольного заражения хомяков, можно сделать вывод, что вакцинация одной или двумя дозами вакцины J&J по 10 9 и 10 10 вирусных частиц за 4 недели до контрольного заражения защищает животных от заболевания средней и тяжелой степени, о чем свидетельствует снижение вирусной нагрузки и гистопатология в нижних дыхательных путях. Степень этой защиты коррелирует с титрами антител. Напротив, преимущества вакцины с точки зрения защиты верхних дыхательных путей не очевидны, если судить по вирусной нагрузке (материал инфекционной и вирусной РНК), гистопатологическим показателям и иммуногистохимии. Корреляция защиты верхних дыхательных путей с титрами антител четко не установлена.
5.1.4. макаки-резусы
Многие данные в этом разделе взяты из отчета EMA (страницы 47-50 и 54-55) и не могут быть проверены независимо.
Исследование NHP 20-09
- Животных (n=4-6) вакцинировали в/м однократной дозой, которая в два раза превышает дозу для человека (10 11 вирусных частиц), или плацебо (физиологический раствор).
- Заражение произошло через 6 недель с использованием псевдовируса или штамма SARS-CoV-2 USA-WA1/2020 (10 5 TCID 50 ).
- Все животные оставались здоровыми на протяжении всего исследования; не сообщалось о различиях между группами или изменениях во времени клинических показателей, рентгенологических изображений легких, лабораторных параметров воспаления или гистопатологии.
- Показано снижение вирусной нагрузки как в верхних, так и в нижних дыхательных путях.
- Было обнаружено, что однократная иммунизация вакциной J & J индуцирует антитела против спайкового белка, а также нейтрализующие антитела против псевдовируса.
- Т-клеточный ответ, судя по продукции IFN-γ, довольно низкий и вариабельный; ответ IL-4 не обнаруживается.
- Были представлены некоторые ограниченные данные об иммунном ответе на саму провокацию, которую оценивали через 2 недели после вакцинации (на 8-й неделе после иммунизации). Эти данные показали, что уровни нейтрализующих антител после заражения, по-видимому, остаются стабильными, тогда как связывающие антитела, по-видимому, увеличиваются после заражения. Причина этого несоответствия неизвестна.
Исследование NHP 20-14
- Исследование титрования уровня дозы вакцины J&J с применением 10 11 , 5 х 10 10 , 1,125 х 10 10 и 2 х 10 9 вирусных частиц, вводимых в виде разовой дозы каждой (n=5 на уровень дозы).
- Однократная иммунизация вакциной J & J индуцировала защиту от инфекции SARS-CoV-2 в нижних и верхних дыхательных путях. Это наблюдалось во всех дозовых группах, но защита была наиболее сильной при самой высокой из двух самых высоких доз.
- вакцина J & J индуцировала нейтрализующие (измеряемые с помощью нейтрализации псевдовируса) и связывающие (цельный шиповидный белок или рецептор-связывающий домен ELISA) антитела; титры коррелировали с уровнями доз.
- Реакция Т-клеток, измеренная по экспрессии IFN-γ, также была дозозависимой, но в целом довольно низкой и изменчивой.
- Поскольку в носу наблюдалось большее количество прорывных инфекций по сравнению с легкими, эти данные свидетельствуют о том, что для защиты верхних дыхательных путей могут потребоваться более высокие дозы вакцины, которые вызывают более сильный системный иммунный ответ.
Для корреляции анализа защиты данные двух вышеупомянутых исследований, а также третьего исследования (NHP 20-07) были объединены, и были представлены следующие результаты:
- Приматов, отличных от человека, вакцинировали однократной дозой вакцины-кандидата против SARS-CoV-2 на основе Ad26 (от 2 × 10 9 до 10 11 вирусных частиц) с последующим заражением SARS-CoV-2 интраназально и интратрахеально (США, США). WA1/2020, доза: 10 5 TCID 50 ) на неделе 6 или неделе 7.
- Вакцина J & J не оценивалась в исследовании NHP 20-07, но 7 других вакцин-кандидатов Ad26 SARS-CoV-2 были протестированы в сопоставимых условиях.
- Во всех трех исследованиях использовались одни и те же анализы иммуногенности: два анализа нейтрализации псевдовирусов, два анализа ELISA для связывания антител и анализ Т-клеток (IFN-γ ELISpot).
- Во всех исследованиях также использовался один и тот же анализ для определения вирусной нагрузки в бронхоальвеолярном лаваже и мазках из носа: RT-qPCR субгеномной рибонуклеиновой кислоты (sgRNA) гена E SARS-CoV-2.
- Два логистических регрессионных анализа были выполнены независимо: один набор данных состоял из всех кандидатов на вакцины вместе взятых (N = 51), а второй набор данных содержал только вакцины-кандидаты J и J (N = 26).
- На основании данных, полученных с окончательной вакциной-кандидатом и полученных в результате исследований NHP 20-09 и 20-14, дозозависимое усиление гуморального иммунного ответа коррелирует с защитой от инфекции, особенно в верхних дыхательных путях.
- В то время как защита от инфекции в нижних дыхательных путях наблюдалась с несколькими случаями прорыва даже в группах с низкими дозами, вирусная нагрузка в верхних дыхательных путях зависела от дозы.
Согласно данным, приведенным в отчете EMA, вакцинация макак-резусов вакциной J & J во всех дозах с последующим заражением SARS-CoV-2 была связана со значительно более низкими средними показателями патологии легких, чем у невакцинированных или ложновакцинированных. животных, так и при отсутствии вирус-индуцированной патологии легких после контрольного заражения. У контрольных животных в целом, но особенно у контрольной группы того же возраста, пневмония, вызванная после заражения, была очень легкой и без клинических признаков.
5.1.5. Оценка исследований на животных
Животная модель без четких клинических данных не подходит для изучения иммуногенности и очистки от вирусов и, что наиболее важно, не является подходящей моделью заболевания для изучения этой вакцины. Если даже у невакцинированных животных не проявляются симптомы заболевания, как можно продемонстрировать эффективность вакцины против клинического заболевания? Обратите также внимание, что испытания на животных не пытались определить способность вакцины останавливать передачу болезни. Таким образом, испытания на животных не доказывают каких-либо существенных преимуществ вакцины.
Исследования на макаках-резусах и сирийских хомяках показали лишь частичный защитный эффект вакцины против экспериментального заражения SARS-CoV-2 на основе патологических анализов. Информация о клеточном иммунном ответе, вызванном вакциной, очень скудна. Данные о смещении Th1 или Th2 в ответе иммунного ответа и субтипировании Т-клеток после вакцинации и контрольного заражения были довольно ограниченными, а в некоторых исследованиях полностью отсутствовали. Основываясь на индуцированной вакциной продукции IFN-γ, клеточные иммунные ответы были довольно слабыми и вариабельными.
Следует также отметить, что животные в этих исследованиях были молодыми и здоровыми. Они могли заразиться SARS-CoV-2 только путем введения высокой вирусной нагрузки непосредственно в дыхательные пути (трахею). Перенося это на людей, важно помнить, что наиболее уязвимые люди старше и имеют сопутствующие заболевания, которые делают их более восприимчивыми к тяжелому заболеванию COVID-19. Противоречивые результаты исследований на животных ставят под сомнение реальную степень защиты от болезни COVID-19 даже у этих молодых здоровых животных. У пожилых людей со многими сопутствующими заболеваниями и, как правило, менее активной реакцией на вакцинацию защитный эффект вакцины кажется еще более сомнительным.
5.2. Фармакокинетика (ПК)
Фармакокинетика включает абсорбцию, распределение, метаболизм и выведение лекарственного средства (сокращенно ADME). Эти параметры контролируют доступность и использование лекарства — или, в данном случае, вакцины — в организме. Все четыре параметра будут влиять на силу и время действия вакцины на клетки и ткани. Для EMA неприемлемо утверждать, что исследования ADME не имеют отношения к разработке и лицензированию новой вакцины, особенно в данном случае, поскольку рассматриваемый агент не обладает характеристиками надлежащей вакцины.
За исключением некоторых экспериментов, касающихся распределения, исследования ADME не проводились; и в этих исследованиях распространения использовалась не сама вакцина Ad26.COV2.S, а некоторые родственные рекомбинантные вирусные конструкции (см. ниже). Вакцина, в которой используется совершенно новая технология, требует тщательного мониторинга во всех направлениях, и ключевым аспектом является то, как компоненты вакцины распределяются, метаболизируются и расщепляются в организме. Также необходимо проверить, не выделяются ли какие-либо остатки, которые могут загрязнить окружающую среду и загрязнить такие ресурсы, как питьевая вода.
5.2.1. Распределение
Было проведено два исследования на кроликах для изучения биораспределения рекомбинантных вирусных частиц [ 3 ] (стр. 50-51). Рассматриваемые вакцины были получены из одного и того же вектора Ad26, но кодировали антигены, отличные от спайкового белка SARS-CoV-2. В одном исследовании вирусы вводили внутримышечно в дозах 5×10 10 вирусных частиц. Образцы тканей собирали на 11, 61 или 91 день после инъекции. Во втором исследовании вакцину на основе Ad26 вводили в дозе 10 11 вирусных частиц, а животных забивали на 11, 90, 120 или 180 день после инъекции.
Ткани животных анализировали на ДНК вектора Ad26 с использованием количественного анализа ПЦР. Согласно отчету EMA, обе протестированные вакцины на основе Ad26 продемонстрировали схожий характер системного распределения и клиренса, несмотря на наличие разных трансгенных вставок. ДНК вектора была в первую очередь обнаружена в месте инъекции, в дренирующих лимфатических узлах и, в меньшей степени, в селезенке. Количество ДНК Ad26 в этих тканях уменьшалось медленно, небольшое количество оставалось в подвздошном лимфатическом узле одного животного через 180 дней. В одном из двух исследований ДНК вектора была ниже предела обнаружения во всех других органах. Биораспределения в половые железы (яичники и яички) не обнаружено.
В отчете EMA не указано, какие органы были исследованы и в какие моменты времени была обнаружена ДНК. В отчете также утверждается, что только в одном из двух исследований все органы, кроме указанного, не содержали ДНК. Что нам делать со вторым исследованием, которое, по-видимому, обнаружило ДНК в других органах? Нет сведений о том, изучались ли, например, центральная и периферическая нервные системы и костный мозг. На основании того, что известно о биораспространении аденовирусов в целом, следует предположить, пока не доказано обратное, что вакцина также проникает в нервную ткань и костный мозг с непредсказуемыми побочными эффектами. Кроме того, поскольку две рекомбинантные вирусные конструкции не экспрессировали спайковый белок SARS-CoV-2, эти исследования могут недооценивать степень проникновения вируса в головной мозг (см.6.8.1 ).
Несмотря на то, что эти данные являются ключевыми, они не были доступны на момент утверждения. Действительно, персистенция ДНК была показана в различных других опубликованных доклинических исследованиях, которые продемонстрировали присутствие ДНК вакцины аденовектора в течение до 2 лет после внутримышечной инъекции с низкой, но обнаруживаемой экспрессией и иммуногенностью на мышиной модели [ 12 ] .
5.3. Токсикология
Профиль безопасности вакцины J & J был оценен в двух токсикологических исследованиях на кроликах [ 3 ] (стр. 51-53).
5.3.1. Токсичность повторной дозы
Три внутримышечные инъекции вакцины J & J, содержащие 10 11вирусные частицы или плацебо (физиологический раствор) вводили в 1, 15 и 29 дни, а испытания проводили в течение 3 недель после последней вакцинации. Согласно отчету ЕМА, токсикологический анализ выявил незначительное повышение температуры тела, снижение массы тела, а также изменение лабораторных показателей крови. Отмечалось увеличение количества моноцитов и лимфоцитов и повышение уровня белков плазмы, связанных с воспалением (С-реактивный белок, фибриноген и глобулины). При гистологическом исследовании выявлена повышенная лимфоидная клеточность зародышевых центров в подколенных и подвздошных лимфатических узлах и селезенке. Эти результаты были частично или полностью обратимы через 3 недели после инъекции.
Отчет об оценке EMA не содержит подробной информации о том, что именно было или не было исследовано. Прозрачность результатов возможно измененных параметров крови может пролить свет на то, как тромбоз, возникающий у некоторых вакцинированных людей (см. Раздел 9.3 ), связан с вакциной. Кроме констатируемого повышения уровня фибриногена в плазме, другие показатели крови, связанные со свертываемостью крови, не упоминаются. Во время клинических испытаний у испытуемых такие показатели крови также не контролировались. В этом контексте мы должны отметить, что есть основания полагать, что сам шиповидный белок SARS-CoV-2 и иммунная реакция на него могут запускать свертывание крови (см. раздел 6.8 ).); поэтому нам необходимо знать, исследовались ли соответствующие параметры крови на этой модели животных или нет.
5.3.2. Репродуктивная токсичность
Это было изучено путем инъекции самкам кроликов однократной дозы вакцины J & J, содержащей 10 11 , либо за 7 дней до спаривания, либо на 6-й день беременности, либо на 20-й день беременности. Не наблюдалось неблагоприятного воздействия на массу тела матери или фертильность, а также на массу тела плода или морфологию. Влияние на фертильность самцов и токсичность при повторном приеме, по-видимому, не оценивались, и количество тестируемых животных не указано, поэтому статистическую мощность этого исследования невозможно оценить.
6. J&J и EMA игнорируют риски и опасности
Выше мы обобщили довольно ограниченные испытания на животных и другие неклинические данные, которые EMA сочла достаточными для выдачи разрешения на экстренное использование вакцины J&J компании J&J. Мы утверждаем, что, принимая эти доказательства, EMA поступило небрежно, как и другие регулирующие органы в Южной Африке и во всем мире. Далее мы обсудим существующие доказательства, как клинические, так и неклинические, которые должны были заставить EMA потребовать гораздо более тщательных тестов и документации.
6.1. Вторичная фармакодинамика и фармакология безопасности
В то время как первичная фармакодинамика связана с предполагаемыми и ожидаемыми эффектами лекарства, вторичная фармакодинамика относится к его непреднамеренным, «нецелевым» эффектам. Фармакология безопасности — родственная концепция, фокусирующаяся на вредных, обычно непреднамеренных эффектах. В отчете EMA говорится, что исследования ни в одной из категорий не проводились, и оно считает это приемлемым, поскольку соответствует общим рекомендациям, применимым к вакцинам [ 3 ] (стр. 50):
… в соответствии с рекомендациями ВОЗ по доклинической оценке вакцин отдельные фармакологические исследования безопасности не считаются необходимыми.
Другими словами, J & J была освобождена от обязанности доказывать безопасность своего продукта, просто используя семантический трюк, называя эту экспериментальную генную терапию «вакциной». Требования к тестированию безопасности, которые действительно должны были быть применены в этом случае, — это требования к продуктам генной терапии, которые требуют очень сложных долгосрочных последующих исследований [ 13 ] .
В дополнение к долгосрочным рискам, присущим любому терапевтическому подходу, который включает введение чужеродной ДНК, существуют также очень специфические краткосрочные риски, возникающие в результате известной биологической активности шиповидного белка SARS-CoV-2. Из них три обсуждаются ниже.
6.1.1. Выход фрагмента S1 в кровоток
Вакцина побуждает клетки-хозяева продуцировать молекулы шиповидного белка и подвергать их воздействию клеточной поверхности, где они представляются иммунной системе. Сообщалось, что клетки могут отщепляться и высвобождать фрагмент (пептид S1) шиповидного белка. Возможно, высвобожденные фрагменты S1 могут транспортироваться кровотоком и вызывать неблагоприятные эффекты в отдаленных местах [ 14 ] . Пептид S1 содержит весь рецептор-связывающий домен (RBD) и, таким образом, способен связываться с рецепторами ACE2 на других клетках. Затем эти рецепторы будут перенесены в клетки-хозяева. Уменьшение количества рецепторов ACE2, оставшихся на поверхности клеток, нарушит баланс ренин-ангиотензиновой гормональной системы, что может привести к повреждению клеток, воспалению и тромбозу.
6.1.2. Слияние клеток
Недавно синтезированные молекулы спайкового белка, которые остаются нерасщепленными на клеточной поверхности, также могут связываться с рецепторами ACE2 на других клетках, что может привести к слиянию двух клеток [ 14 , 15 ] . Это напоминает нормальную функцию белка, а именно индуцировать слияние вирусной частицы с мембраной клетки-хозяина; и нельзя предположить, что он полностью подавлен двумя заменами пролина, встроенными в белок (см. раздел 2.1 ). Образующиеся синцитии (слитые клетки) представляют собой гигантские клетки с несколькими ядрами, и они могут проявлять патологическую активность. Небольшого количества спайкового белка достаточно, чтобы запустить этот каскад слияния.
6.1.3. Активация тромбоцитов
Также известно, что тромбоциты экспрессируют рецепторы ACE2 на клеточной поверхности и, таким образом, могут связывать шиповидный белок. In vitro это приводит к прямой активации и агрегации тромбоцитов, распространению тромбоцитов, образованию лейкоцитарно-тромбоцитарных агрегатов и ретракции сгустка. In vivo такие эффекты приводят к повышенному риску образования тромбов. Молекулы шиповидного белка также непосредственно стимулируют тромбоциты к высвобождению гранул, коагуляции и секреции воспалительного фактора.
6.1.4. Вывод
Биологическая активность шиповидного белка SARS-CoV-2 может нанести значительный ущерб клеткам и организму человека несколькими способами. Одобрение вакцины J & J для использования у людей без предварительных фармакологических испытаний безопасности для устранения этих патогенных механизмов является безответственным. Компания J&J также не проводила доклинических исследований фармакодинамических взаимодействий с лекарственными средствами, а это означает, что нет доступных данных о поведении вакцины у реципиентов, у которых наблюдаются физиологические изменения, вызванные заболеваниями, генетическими мутациями, старением или влиянием других лекарств. Например, учитывая, что нарушения свертывания крови и нарушения свертываемости крови были зарегистрированы как при COVID-19, так и после вакцинации, а также учитывая, что многие пожилые люди принимают препараты, препятствующие свертыванию крови, безусловно, было бы важно изучить, как вакцина взаимодействует с такими лекарствами; но такое исследование не проводилось.
6.2. Оценка экотоксичности/экологического риска
Несмотря на то, что вакцина представляет собой генетически модифицированный организм (ГМО), EMA предполагает, что она представляет незначительный риск для здоровья человека и окружающей среды. Соответственно, исследований по оценке экотоксичности/риска для окружающей среды не проводилось [ 3 ] (стр. 53).
Возможность непреднамеренного выброса продуктов ДНК в окружающую среду является еще одной проблемой безопасности. Это может произойти из-за несчастных случаев во время производства вакцины или в процессе вакцинации. Плазмидная ДНК, например, выделенная из бактериальных клеток на первом этапе процесса производства вакцины, может быть весьма устойчива к разрушению в окружающей среде. Следовательно, может быть необходимо изучить потенциальные экологические эффекты, такие как сохранение плазмидной ДНК и ее поглощение другими организмами в окружающей среде. Кроме того, не было исследовано, будут ли вакцинированные люди выделять вакцину или какую-либо ее часть в окружающую среду. Образцы мочи или стула не тестировались на компоненты вакцины, которые могли бы вызвать проблемы у важных муниципальных поставщиков, например, питьевой воды.
Поскольку вакцина содержит ГМО, неиспользованные флаконы с вакцинами или отходы следует утилизировать в соответствии с местными правилами обращения с генетически модифицированными организмами или биологически опасными отходами. Нельзя предполагать, что медицинские клиники, которые будут распределять вакцину, имеют соответствующие средства 2-го уровня биологической опасности, необходимые для безопасной утилизации, и, кроме того, обладают опытом и разрешениями на обращение с ГМО.
6.3. Риск рекомбинации между вакциной и штаммами аденовируса дикого типа
ДНК неспособного к репликации аденовируса, используемого в вакцине J & J, может подвергнуться рекомбинации с ДНК природного, способного к репликации аденовируса. Это может произойти, когда два вируса заразят одну и ту же клетку в организме реципиента вакцины, и это может привести к образованию вируса, который кодирует спайковый белок SARS-CoV-2 и в то же время способен к репликации. В результате возникнут два основных риска:
- Рекомбинантный вирус может реплицироваться в организме реципиента вакцины, и может продуцироваться избыточное количество шиповидного белка с соответствующим повышением токсичности.
- Рекомбинантный вирус может передаваться другим лицам, в том числе тем, кому вакцинация противопоказана.
В Разделе 4.3 мы утверждали, что меры предосторожности, принятые J&J против появления способного к репликации рекомбинантного вируса во время производства вакцины, были недостаточными. Важность этого раздела заключается в том, что даже если бы процесс производства in vitro мог быть полностью защищен в этом отношении, было бы невозможно устранить риск появления рекомбинантного вируса in vivo.
6.4. Ранее существовавший или индуцированный вакциной иммунитет к аденовирусным векторам
Аденовирусы относятся к возбудителям простуды. В настоящее время известно более 50 различных серотипов аденовирусов человека [ 16 ] , и из-за большого количества циркулирующих вирусов и их относительной легкости передачи подавляющее большинство людей были инфицированы несколькими типами аденовирусов в детстве и на протяжении всей жизни. Это означает, что значительная часть населения имеет антитела и Т-клеточный иммунитет к этим вирусам.
6.4.1. Нарушение иммунитета против аденовирусов при вакцинации
Специфический иммунитет или перекрестный иммунитет к определенному серотипу аденовируса человека будет препятствовать использованию этого серотипа для создания аденовекторных вакцин, поскольку
- ранее существовавшие антитела будут связываться с частицами вакцинного вируса и могут предотвращать их поглощение клетками;
- любая клетка, которая поглощает вирусную частицу, начнет экспрессировать не только трансген — в данном случае спайковый белок SARS-CoV-2, — но и аденовирусные белки. Если реципиент уже невосприимчив к рассматриваемому серотипу аденовируса, клетка может быть атакована и разрушена цитотоксическими Т-клетками.
Оба эффекта уменьшат количество экспрессируемого трансгенного продукта. Этого, вероятно, не наблюдалось в доклинических исследованиях вакцины J&J, потому что животные, используемые в таких исследованиях, содержались в клинически стерильных условиях и не были инфицированы естественным путем аденовирусами; однако того же нельзя ожидать от людей.
6.4.2. Серотип-специфический иммунитет различается между континентами.
Следует отметить, что распространенность нейтрализующих антител к различным серотипам аденовирусов может значительно варьироваться в зависимости от географического региона; в частности, серотипы, которые редко встречаются в США или Европе, могут быть весьма распространены в других регионах [ 17–19 ] .
Серотипы аденовирусов, подверженные такой географической изменчивости, могут в разной степени вызывать перекрестный иммунитет к другим серотипам. Таким образом, в некоторых частях мира многие реципиенты вакцины уже могут иметь отчетливый иммунный ответ на вирус, включая как нейтрализующие антитела, так и специфически реактивные Т-клетки.
6.5. Иммунное вмешательство, наблюдаемое в предыдущих усилиях по разработке вакцины
Вакцины на основе аденовектора-5 для человека показали высокую эффективность в доклинических исследованиях, но в клинических испытаниях они оказались ниже ожидаемых, поскольку у участников уже был человеческий иммунитет к Ad5 из-за естественного воздействия. В частности, в фазе I исследования у лиц с ранее существовавшим иммунитетом к этому серотипу наблюдался более низкий иммунный ответ по сравнению с участниками без ранее существовавшего иммунитета [ 20 ] .
Ранее существовавший иммунитет к аденовектору 26 оценивали в исследовании VAC31518COV1001 (фаза I/IIa) путем
измерения нейтрализующих антител к основному вектору Ad26 на исходном уровне и перед второй
инъекцией плацебо на 57-й день [ 3 ] (стр. 68ff). Согласно отчету EMA, у 9% участников группы плацебо обнаруживаются антитела, нейтрализующие Ad26 [ 3 ] (стр. 72). Кроме того, в более ранних крупных клинических исследованиях вакцины, проведенных J & J с одним и тем же вектором основы Ad26, серопревалентность Ad26 варьировалась в зависимости от континентов. Самая высокая серораспространенность была зарегистрирована в Африке (77,9%), за ней следуют Бразилия (44%), Азия (41,4%). Гораздо более низкие значения наблюдались в Северной Америке (15,1%) и Европе (11,6%) [ 3 ].(стр. 167).
По данным EMA, потенциальное влияние природного или индуцированного вакциной существовавшего ранее иммунитета против Ad26 на эффективность вакцины остается неясным. Исходя из опыта серопревалентности аденовекторов, мы должны ожидать, что иммунитет к вектору будет серьезно ограничивать иммунизирующий эффект вакцины J&J.
6.5.1. Иммуноопосредованные побочные реакции
Ранее существовавший иммунитет к HAd5 также был связан с неблагоприятными исходами, помимо вмешательства в вакцинацию [ 21 ] . Инъекция препаратов рекомбинантного аденовируса может вызывать сильные воспалительные реакции, отчасти из-за активности структурных вирусных белков [ 22 ] .. Активация врожденных ответов, по-видимому, включает несколько путей, включая как минимум два толл-подобных рецептора, а также экспрессию интерферона 1 типа. Кроме того, NALT3 распознает ДНК аденовектора в цитозоле, что, в свою очередь, запускает провоспалительный цитокиновый ответ. В целом, аденовирусы и аденовекторы распознаются врожденными сенсорами несколькими путями, которые приводят к активации высвобождения цитокинов и хемокинов, что, в свою очередь, обуславливает ограничивающую дозу токсичность при использовании аденовекторов у людей.
6.5.2. Смерть из-за генной терапии аденовируса в клинических испытаниях на людях
Ярким примером неблагоприятной реакции на аденовирусную генную терапию, вероятно, иммуноопосредованной, является первая смерть в эксперименте I фазы генной терапии, который произошел в 1999 году в Пенсильванском университете [ 23 , 24 ] . Они использовали дефектный по репликации аденовирус, Ad5-vector (вводимая доза: 6 × 10 11вирусных частиц на кг массы тела), чтобы доставить потенциально терапевтическую ДНК в печень. Приблизительно через 18 часов у 18-летнего субъекта развилась желтуха и нарушение сознания. Последующее клиническое течение было отмечено синдромом системной воспалительной реакции с биохимически обнаруживаемой недостаточностью многих систем органов, что привело к смерти через 98 часов после переноса гена. Посмертное исследование соответствовало клиническому течению, и последовательности векторной ДНК легко обнаруживались в большинстве тканей. У субъекта были обнаружены высокие уровни IL-6 и IL-10 в сыворотке, но нормальный TNF-α сразу после введения вектора. Этот опыт указывает на ограниченность исследований на животных в прогнозировании реакций человека, которые в этом фатальном случае были приписаны неожиданно сильной иммунной реакции [ 25 ].] .
Дальнейшие исследования абсолютно необходимы для лучшего понимания иммунного ответа на дефектные по репликации аденовирусные векторы и их токсичности, а также для того, чтобы понять существенные различия между отдельными субъектами. Учитывая ограниченность наших текущих знаний, безответственно вводить вакцины на основе аденовирусов, такие как вакцина J & J, здоровым людям, особенно в таких больших масштабах, как это делалось сразу после получения разрешения на экстренное использование.
6.5.3. Снижение эффективности повторных инъекций
Наконец, даже у пациентов без ранее существовавшего иммунитета к Ad26 первая инъекция вызовет иммунитет не только к трансгенному продукту (спайковому белку SARS-CoV-2), но и ко всем аденовирусным белкам, гены которых остаются интактными (см. Рисунок 1 ). Этот недавно индуцированный иммунитет будет мешать второй и всем последующим инъекциям. Российская вакцина Sputnik V использует два разных серотипа аденовируса (26 и 5 соответственно) в качестве векторов для первой и второй дозы, соответственно, для решения этой проблемы [ 26 ] ; однако J&J и AstraZeneca предпочитают делать вид, что его не существует.
6.6. Генотоксичность и канцерогенность
Одна из тем, бросающаяся в глаза отсутствием среди исследований на животных по токсикологии (см. Раздел 5.3 ) — генотоксичность и канцерогенность. Здесь мы объясним, почему отказ J & J от таких исследований и молчаливое согласие EMA на это являются в корне ошибочными.
6.6.1. Аденовирусы имеют очень широкий спектр клеток-хозяев.
Одной из особенностей аденовирусов, которая делает их привлекательными в качестве векторов для генной терапии, является их очень широкий спектр клеток-хозяев. Они могут инфицировать и, следовательно, доставлять гены в большинство делящихся и неделящихся клеток человека, поскольку почти все клетки экспрессируют первичный аденовирусный рецептор (CD46) и вторичные интегриновые рецепторы [ 27 ] .
В исследовании распространения J & J (раздел 5.2.1 ) ДНК аденовируса была обнаружена только в некоторых тканях, но чувствительность обнаружения ДНК зависит от доли инфицированных клеток в ткани. Таким образом, даже если анализ большого органа в целом может не выявить вирусную ДНК, отдельные клетки органа вполне могут заразиться вирусом. Следовательно, мы должны ожидать, что вакцина будет обнаружена во всех тканях; соответственно, генотоксические эффекты могут проявляться во многих типах клеток и органов.
6.6.2. Встраивание ДНК аденовируса в геном клетки-хозяина
Уже несколько десятилетий известно, что вирусная ДНК может интегрироваться в геном клеток-хозяев млекопитающих [ 28 ] . Эти взаимодействия представляют интерес не только для вирусологии опухолей и генной терапии, но и для роли вирусной ДНК как эволюционного механизма. Таким образом, было научно продемонстрировано многими способами, что аденовирусы вводят свой генетический материал в хромосомную ДНК клеток человека посредством как негомологичной, так и гомологичной рекомбинации [ 29-32 ] .
Место интеграции аденовируса в ДНК клетки-хозяина контролировать нельзя [ 29 ] . Существует более 70 различных аденовирус-трансформированных клеточных линий, которые демонстрируют неидентичные паттерны вставок вирусной ДНК
в геном хозяина [ 31 ] .. Исследования in vitro на хомяках, мышах, крысах и людях не выявили высокоспецифичных участков вставки вирусной ДНК в клеточный геном. Опубликованные работы по аденовирусным векторам показывают, что в большинстве случаев геном вектора оставался неповрежденным после интеграции; то же самое наблюдалось и с ДНК аденовируса дикого типа. Некоторые события интеграции происходили совершенно неспецифически, без какого-либо обнаруживаемого сходства последовательностей между ДНК хозяина в месте встраивания и вирусным геномом, тогда как в других случаях можно было различить короткие гомологичные участки вблизи мест соединения.
6.6.3. Биологические последствия введения вирусной ДНК
Следует подчеркнуть, что все сайты интеграции в геноме клетки-хозяина оказались транскрипционно активными. Возникающий генотоксический эффект может проявляться по-разному [ 33 – 35 ] :
- Инактивация гена: вставка может произойти в хромосомном гене и нарушить его. Это может привести к потере важных продуктов клеточных генов (т. е. белков) и, таким образом, потенциально к развитию заболеваний, включая рак.
- Активация генов: вирусные промоторы и вставка вирусной ДНК в регуляторные элементы хромосомных генов могут увеличивать скорость транскрипции этих генов. Это также может превратить клетку-хозяина в раковую клетку, которая затем может пролиферировать и превратиться в клинически проявляющуюся опухоль. Интеграция вирусной ДНК является важной парадигмой современной биологии опухолей.
- Генная регуляция: могут быть затронуты другие механизмы транскрипционной и эпигенетической регуляции, повышая или снижая уровни экспрессии отдельных белков с непредсказуемыми результатами.
- Хромосомное повреждение: другими возможными эффектами интеграции аденовектора являются хромосомные делеции, инверсии или транслокации. Такая потеря или перестройка генетического материала может затрагивать большое количество генов и, соответственно, иметь более серьезные последствия, чем рассмотренные выше эффекты. Например, хромосомные транслокации часто связаны с лейкемией.
- Аутоиммуноподобное заболевание: интеграция гена шиповидного белка в клетку-хозяин может привести к постоянной экспрессии этого антигена. Это заставит иммунную систему атаковать эти клетки и может привести к аутоиммунному заболеванию.
Возникновение злокачественных новообразований посредством интеграции ДНК и активации онкогена было продемонстрировано, например, в клинических испытаниях ретровирусного (не аденовирусного) вектора для лечения детей с SCID-X1 (тяжелый комбинированный иммунодефицит) [ 36 ] . Обычно они проявляются через несколько лет после завершения лечения [ 37 ] .. Таким образом, тщательные долгосрочные исследования возможных генотоксических эффектов хромосомной интеграции на стадиях доклинических и клинических испытаний абсолютно необходимы для достоверного анализа риска и пользы векторов переноса генов, таких как вакцина J & J. Подробная информация о генотоксичности после переноса генов уже доступна для векторов, полученных из вирусов семейств ретровирусов и парвовирусов. Напротив, существует лишь несколько исследований хромосомной интеграции ДНК аденовектора после переноса генов в клеточные культуры, и еще меньше известно об интеграции аденовектора in vivo [ 32 ] .
Безответственно использовать аденовирусный вектор в качестве вакцины для людей, когда имеется так мало научных данных, охватывающих такой очень короткий период наблюдения. Хотя обычный жизненный цикл аденовирусов является внехромосомным, опасно предполагать, что аденовекторы никогда не интегрируются в клеточный геном; нет исследований, подтверждающих этот момент. Напротив, в предыдущих исследованиях in vivo было показано, что инъекция хомякам аденовируса дикого типа типа 12 (Ad12) приводила к образованию опухоли из-за хромосомной интеграции ДНК вируса и экспрессии белков, способствующих развитию рака [ 31 ] . Таким образом, для любой вакцины на основе аденовектора должны быть категорически необходимы долгосрочные последующие исследования (см. Раздел 6.6.6 ).
6.6.4. Эффективность введения аденовирусной ДНК
Стивен и др. исследовали частоту встраивания в ДНК клетки печени рекомбинантного аденовируса типа 12 с использованием ограниченного количества вирусных частиц, так что только незначительное количество клеток могло бы поглотить более одной вирусной частицы. В этих условиях примерно семь из 100 000 клеток, поглотивших вирус, оказались с хромосомно вставленной копией его генома. Одна доза вакцины J&J для человека содержит 5×10 10 частиц; если каждый из них был принят клеткой, то количество событий интеграции, ожидаемое по данным Stephen et al. будет 700 000.
На первый взгляд это число может показаться не очень большим по сравнению с частотой спонтанных мутаций. Однако большинство спонтанных мутаций являются точечными мутациями, которые обычно не вызывают такой же степени повреждения генов, как интеграция полных или частичных геномов аденовектора, что с гораздо большей вероятностью приведет к полной инактивации генов или даже к хромосомным повреждениям.
6.6.5. Открытые вопросы
Механизм внедрения чужеродной ДНК в клетки млекопитающих еще не до конца изучен на молекулярном уровне. Соответственно, перед утверждением любых вакцин на основе ДНК-векторов необходимы дальнейшие исследования и лучшее понимание. В настоящее время исследователи в основном сосредоточены на следующих темах:
- Происходит ли вставка случайным образом по всему геному или она нацелена на определенные сайты?
- Если вставка не случайна: каковы характеристики хромосомных участков, на которые нацелена вставка чужеродной ДНК, и в каких мотивах последовательности чужеродная ДНК рекомбинирует с клеточной ДНК?
- Какие клеточные или вирусные факторы способствуют внедрению чужеродной ДНК?
- Каковы эффекты встроенных генов на экспрессию генов хозяина, расположенных рядом со встроенной ДНК, или на экспрессию генов, расположенных в более отдаленных местах?
Все эти вопросы имеют прямое отношение к рискам, связанным с использованием вакцины J & J, но в настоящее время на них нельзя ответить. В частности, неизвестно, как долго векторная ДНК может сохраняться в клетке без интеграции. Доклинические исследования показали наличие эписомной (внехромосомной) ДНК на срок до 2 лет после внутримышечной инъекции с низкой, но обнаружимой экспрессией и иммуногенностью на мышиной модели [ 38 ] .. По данным FDA, персистенция ДНК обычно не проявляется в эктопических участках в исследованиях биораспределения и персистенции, но остается обнаруживаемой в месте инъекции в течение периодов, превышающих 60 дней. Такая длительная персистенция в ядрах трансфицированных клеток увеличивает риск того, что чужеродная ДНК в конечном итоге интегрируется в хромосомы хозяина, и, следовательно, долгосрочный риск мутагенеза и индукции опухоли.
6.6.6. Необходимость долгосрочных последующих исследований продуктов генной терапии
Интегрирующие векторы генной терапии могут сохраняться в организме на протяжении всей жизни трансдуцированных клеток пациента. Согласно руководству, опубликованному FDA в 2020 году [ 13 ] , лейкемия была зарегистрирована более чем в одном исследовании, в котором испытуемые получали клетки, генетически модифицированные in vitro с использованием γ-ретровирусных векторов. Достижения в аналитических методах анализа мест интеграции в образцах пациентов, собранных во время длительного наблюдения, позволили получить некоторое представление о возможных механизмах, связанных с возникновением таких отсроченных нежелательных явлений. Такие риски можно снизить за счет усовершенствования схемы векторов, а также продолжительности и схемы долгосрочных последующих наблюдений.
В соответствии с общей рекомендацией FDA, доклинические исследования на соответствующих видах животных также должны были быть проведены с вакциной J & J для оценки продолжительности ее персистенции в клетках различных тканей, поскольку в настоящее время неизвестно, как долго она действует. продукт генной терапии сохраняется в организме хозяина после инъекции. Если такие исследования обнаружат доказательства хромосомной интеграции, то все клинические протоколы должны включать долгосрочные последующие наблюдения для надлежащей защиты человека. Только после завершения такого исследования можно было достоверно оценить риск отсроченных побочных эффектов.
В отсутствие такой специфической информации, некоторая степень встраивания аденовектора в геном клеток-хозяев должна считаться вероятной по причинам, которые обсуждались выше. В этом контексте мы отмечаем, что применимая рекомендация FDA гласит, что для продуктов генной терапии, которые могут интегрироваться в геном, необходимо долгосрочное наблюдательное исследование (LTFU) продолжительностью до 15 лет, включая изучение новых клинических состояний, таких как новые злокачественные новообразования или гематологические заболевания, новый случай или обострение ранее существовавшего неврологического заболевания, ревматологического или другого аутоиммунного заболевания или потенциально связанная с продуктом инфекция. Ничего из этого не было сделано с вакциной J&J.
6.6.7. Преимущество профилактической вакцинации не гарантирует риска долговременного генетического повреждения.
По данным FDA, продукты генной терапии, полученные из аденовирусов, обычно представляют низкий риск отсроченных побочных эффектов. Если бы таким продуктом генной терапии лечили только тяжелобольных людей, соотношение риска и пользы вполне могло бы быть приемлемым, если бы люди, получавшие такое лечение, действительно излечились от своей болезни и если бы не было более безопасного традиционного лечения. Но с аденовекторными вакцинами COVID-19 миллионы людей подвергаются риску долгосрочного генетического повреждения, даже если они здоровы, а вирусное заболевание, которое, как предполагается, предотвращается вакцинами, обычно протекает в легкой форме и самоограничивается. Даже если бы эти вакцины были эффективны, чего на самом деле нет (см. Раздел 8 ), риск поздних побочных эффектов не был бы ни пропорциональным, ни приемлемым.
6.7. Высокий риск антителозависимого усиления и тяжелого заболевания легких после вакцинации
Поскольку клинические испытания проводились по значительно ускоренному графику с перекрытием, а не последовательным вторым и третьим этапами («телескопирование»), не было определено, произойдет ли антителозависимое усиление (ADE) после иммунизации против SARS-CoV-2. . Основываясь на обзоре многочисленных научных данных (см. ниже), вероятность того, что ADE возникнет у реципиентов этой коронавирусной вакцины, достаточно высока, чтобы быть значительной для отказа от этих вакцин.
Антителозависимое усиление заболевания (ADE) наблюдалось у людей с несколькими природными видами вирусов, а также с вакцинами против респираторно-синцитиального вируса (RSV), вируса денге и кори [ 39 , 40 ] . Вызванное вакциной усиление заболевания также наблюдалось для вирусов SARS и MERS [ 41 , 42 ] и для кошачьего коронавируса [ 43 ] , которые тесно связаны с SARS-CoV-2. В частности, SARS-CoV и SARS-CoV-2 в высокой степени гомологичны, с 80% идентичностью последовательностей на уровне генома, а вирусным рецептором на клетках-хозяевах для обоих является ACE2.
Противовирусная вакцина, вызывающая ADE, будет усугублять, а не смягчать соответствующую вирусную инфекцию. Иммунные механизмы этого усиления неизменно включают антитела. В простейшем случае антитела, связавшиеся с вирусной частицей, способствуют захвату последней клетками за счет связывания своими незанятыми (Fc ) концами с рецепторами Fc на этих клетках. Кроме того, взаимодействие комплексов антитело-антиген с рецепторами Fc на макрофагах изменяет функцию этих клеток и вызывает повреждение легких за счет гипериммунитета и перекоса Th2 Т-клеток (см. ниже). Примечательно, что в ADE вовлечены как нейтрализующие, так и ненейтрализующие антитела.
6.7.1. Уроки экспериментальных вакцин против SARS-CoV
Один из первых кандидатов на вакцину против SARS-CoV был получен из инактивированного цельного вируса SARS-CoV без адъювантов. В экспериментах на животных этот вакцинный препарат обеспечивал лишь умеренную защиту, поскольку индуцировал только низкие титры нейтрализующих антител, но был способен на ранней стадии очищать легкие от вирусов у инфицированных хорьков.
У мышей инактивированные цельновирусные вакцины с квасцовым адъювантом или без него также обеспечивали лишь частичную защиту, но вызывали тяжелую эозинофильную патологию легких, подобную наблюдаемой при повторном заражении SARS-CoV после естественного первичного заражения [ 41 ] . В исследовании повторного заражения, гомологичного SARS-CoV, 11 из 12 вакцинированных африканских зеленых мартышек не имели репликации вируса на 5-й день после повторного заражения. Однако частота и тяжесть воспаления легких не снизились, несмотря на снижение репликации вируса, опосредованное прогрессирующее увеличение антител против SARS-CoV при повторном заражении [ 44 ] .
Эозинофильная иммунопатология в легких также наблюдалась в другом исследовании на мышах, в котором изучалась вакцина против SARS-CoV с двойной инактивацией с адъювантом на основе квасцов или без него [ 45 ] , а также вакцина с адъювантом на основе квасцов, направленная против нуклеокапсидного белка SARS-CoV [ 45]. 46 ] . Все варианты вакцин продемонстрировали слабую защиту от нелетального гетерологичного заражения у старых мышей.
Эти совокупные данные вызывают серьезную озабоченность в отношении безопасности вакцин против SARS-CoV, предполагая общую проблему Th2-поляризующего ответа [ 47 ] .. Это подчеркивает необходимость дополнительных исследований молекулярных механизмов, управляющих вызванной вакциной эозинофилией и неэффективностью вакцины, особенно на моделях старых животных, которые лучше отражают человеческие заболевания у более уязвимых людей. На сегодняшний день неизвестно, могут ли люди, вакцинированные против COVID-19, быть аналогичным образом предрасположены к тяжелой иммунной патологии легких при заражении SARS-CoV-2. Представляется вероятным, что заражение естественными коронавирусами или инъекция вакцин против не только индуцирует нейтрализующие антитела к вирусным антигенам, но также создает уникальную проблему, связанную с иммунным ответом, обусловленным Th2. У многих животных, иммунизированных вакцинами против коронавируса, эозинофильная патология обнаруживается в легких после нового заражения вирусом дикого типа или после вакцинации [ 45 – 48 ].] . О том же явлении сообщалось после иммунизации мышей рекомбинантными шиповидными белками коронавируса.
Генные вакцины также были опробованы против атипичной пневмонии. Еще в 2005 году был сконструирован модифицированный поксвирусный вектор, несущий полный ген вирусного шиповидного белка SARS-CoV. Результаты были почти такими же, как и с обычными вакцинами, а именно: усиление легочной патологии после заражения вирусом [ 49 ] .
Наиболее многообещающим путем к действительно защитной вакцине может быть сосредоточение внимания не на методе доставки антигена, а на адъюванте. Исследования на мышах, опубликованные в 2015 году, показали, что состав шиповидных белков SARS-CoV или инактивированных цельновирусных вакцин с новыми полисахаридными адъювантами на основе дельта-инулина повышает титры нейтрализующих антител [ 48 ] . Этот тип экспериментальной вакцины также обеспечивает защиту как от манифестного заболевания, так и от развития легочной эозинофильной иммунопатологии.
Другой стратегией снижения уровня эозинофильной патологии в легких является использование агонистов Toll-подобных рецепторов вместе с инактивированной цельновирусной вакциной против SARS-CoV [ 47 ] . Необходимы дальнейшие углубленные исследования для выяснения долгосрочных защитных эффектов различных адъювантов и разработки более безопасных и эффективных вакцин. Подобных усилий не предпринималось при разработке обсуждаемой здесь вакцины J&J.
6.7.2. Доказательства ADE при COVID-19
Возможность ADE в контексте естественного заражения SARS-CoV-2, а также вакцинации против него была признана [ 50 ] . В частности, ADE из-за антител к шиповидным белкам, вырабатываемых другими штаммами коронавируса, был вызван для объяснения специфического географического распределения тяжести клинического заболевания COVID в Китае [ 51 ] . Johnson & Johnson и регулирующие органы также хорошо осведомлены о риске ADE. Отчет EMA резюмирует информацию, предоставленную J&J, следующим образом [ 3 ] (стр. 181):
«Вакцинно-ассоциированное усиленное заболевание (VAED), включая вакциноассоциированное усиленное респираторное заболевание (VAERD)» было включено в качестве важного потенциального риска. … Неклинические исследования сирийских хомяков, иммунизированных Ad26.COV2.S, и NHP не выявили признаков VAED или VAERD … Данные клинических испытаний не показали никаких признаков наличия VAED, включая VAERD. Однако, поскольку долгосрочные данные по безопасности и эффективности еще не доступны, риск VAED/VAED остается важным потенциальным риском.
В целом ясно, что риск ADE признается в теории, но не рассматривался с какой-либо степенью строгости у реципиентов вакцины. Учитывая многочисленные свидетельства ADE с экспериментальными вакцинами против SARS, это неприемлемо.
6.7.3. Вывод
Таким образом, иммунопатологическая реакция Th2-типа с тяжелым воспалением легких и инфильтрацией эозинофилов при заражении вакцинированных животных произошла в трех животных моделях, включая две разные линии инбредных мышей с четырьмя различными типами вакцин против SARS-CoV, как с квасцовым адъювантом, так и без него. Ни одна из различных вакцин против SARS-CoV никогда не была одобрена для использования на людях. До тех пор, пока не будет представлено доказательство обратного, мы должны предположить, что текущий урожай вакцин против COVID-19, включая вакцину J & J, может вызывать ADE. В этом контексте мы отмечаем, что вакцина J & J продемонстрировала почти трехкратное увеличение риска заражения COVID по сравнению с отсутствием вакцинации в недавнем крупномасштабном исследовании, опубликованном CDC (см. Раздел 8 ).). ADE кажется наиболее простым объяснением этого наблюдения из реального мира.
6.8. Тромбоэмболическая болезнь, тромбоцитопения и диссеминированное внутрисосудистое свертывание
Побочные реакции, связанные со свертываемостью крови, возникали при применении всех генных вакцин против COVID-19 (см. Раздел 9 ). Есть два основных механизма, которые применимы ко всем из них, а именно
- прямое воздействие шиповидного белка и
- атака иммунной системы на клетки, которые поглотили вакцину и экспрессируют шиповидный белок.
В вакцинах на основе аденовирусов, производимых Johnson & Johnson и AstraZeneca, существует третий механизм: было показано, что аденовирусы как таковые, даже не кодируя спайковый белок SARS-CoV-2 или какой-либо другой трансген, вызывают свертывание крови. Рассмотрим каждый из этих механизмов по очереди.
6.8.1. Токсичность шиповидного белка
Спайковый белок SARS-CoV-2 является основной причиной проявлений тяжелого заболевания COVID. 1 Некоторые из его вредных эффектов опосредованы фрагментом S1, растворимой белковой молекулой, которая высвобождается из инфицированных клеток в результате протеолитического расщепления прикрепленного к поверхности шиповидного белка. Уровень S1 в плазме крови коррелирует с тяжестью заболевания [ 52 ] . S1 может связываться с рецепторами ACE2 на эндотелиальных клетках и тромбоцитах (тромбоцитах крови), что может способствовать свертыванию крови [ 14 , 53 ] .
Спайковый белок также повреждает капиллярные барьеры в легких и головном мозге [ 54 , 55 ] . В дополнение к рецептору ACE2 белок связывается с Toll-подобным рецептором 4 (TLR-4) и с белком клеточной поверхности CD209 (CLEC4M) [ 56 ] ; эти взаимодействия расширяют диапазон клеток-хозяев вируса. TLR-4, в частности, был вовлечен в миокардит, который связан с вирусной инфекцией [ 57 ] , а также является заметным побочным эффектом вакцин против COVID, особенно у молодых мужчин.
На фоне этой общеизвестной токсичности очень странно, что все современные вакцины на основе генов, включая вакцину J & J, были разработаны для индукции экспрессии функционально активного спайкового белка в клетках нашего тела 2 , а не чем «анатоксин», то есть иммуногенное, но безвредное производное токсического белка. Токсоиды могут быть получены простыми средствами и уже давно успешно используются в качестве вакцин, например, при дифтерии и столбняке, одноименные токсины которых можно сделать нетоксичными путем несложной химической модификации. Используя современные методы молекулярной биологии, должно было быть достаточно легко создать нетоксичное производное спайкового белка для вакцинации.
Опасения по поводу токсичности спайк-белка, вызванного вакциной, вовсе не просто гипотетичны. Уровни S1 в плазме крови, обнаруженные у привитых, сравнимы с таковыми при тяжелых формах вирусной инфекции [ 52 , 58 ] . Соответственно, после вакцинации следует ожидать такого же серьезного пагубного воздействия на целостность сосудов; и это действительно подтверждается очень большим количеством тяжелых нежелательных явлений (см. Раздел 9 ).
6.8.2. Риск свертывания и кровотечения из-за аутоиммунной атаки
Помимо прямой токсичности шиповидного белка, мы должны ожидать дополнительного вреда из-за иммунных реакций против него. Если белок экспрессируется в эндотелиальных клетках сосудов — самом внутреннем клеточном слое кровеносных сосудов — тогда иммунная реакция на него может разрушить эти клетки. Возникшее поражение сосудов снова активирует свертываемость крови. Эта иммунная реакция может включать цитотоксические Т-клетки, а также антитела, которые запускают систему комплемента и другие иммунные эффекторные механизмы. Обратите внимание, что этот механизм повреждения клеток будет действовать и в других тканях — любая клетка организма, которая экспрессирует шиповидный белок, таким образом, станет мишенью для иммунной системы.
Прямая белковая токсичность имеет большое значение, поскольку она не связана с иммунной реакцией и, следовательно, может быть вызвана сразу же даже у людей без ранее существовавшего иммунитета. Механизм иммунной атаки будет особенно опасен для лиц с ранее существовавшим иммунитетом. Такой иммунитет может возникнуть в результате заражения вирусом SARS-CoV-2 или в результате предыдущей инъекции вакцины. Кроме того, перекрестный иммунитет, вызванный другими коронавирусами, также может способствовать разрушению клеток посредством иммунной атаки.
6.8.3. Свертывание крови, индуцированное аденовирусными переносчиками: исследования на животных
Лафон и др. [ 59 ] исследовали возникновение тромбоза после аденовирус-опосредованного переноса генов в нормальные и атеросклеротические артерии в экспериментах на животных. Дефектный по репликации аденовектор, экспрессирующий репортерный ген β-галактозидазы, вводили в нормальные и атеросклеротические артерии. Через три дня животных умерщвляли и исследовали на наличие тромбов и на наличие активности β-галактозидазы. В атеросклеротических артериях легко обнаруживались неокклюзионные тромбы. Активность β-галактозидазы была обнаружена преимущественно в эндотелиальном (самом внутреннем) слое сосудов. Тромбы образовывались и после введения аденовирусных частиц без трансгена.
В доклиническом исследовании на макаках-резусах было показано, что введение репликативно-дефицитного аденовирусного вектора снижает количество тромбоцитов и время полужизни тромбоцитов дозозависимым образом [ 60 ] . Введение 6 ×
10 12 частиц на кг вызывало тяжелую тромбоцитопению (снижение количества тромбоцитов до 90%) и уменьшение периода полувыведения тромбоцитов с обычных 111 часов до 22 часов. Другое исследование на тех же видах животных с введением 10 13 частиц рекомбинантного аденовируса с делецией E1 или вируса, который стал неспособным к репликации под действием УФ-облучения, также показало тяжелую тромбоцитопению и признаки диссеминированного внутрисосудистого свертывания крови [ 61 ] .. То же самое наблюдалось у кроликов после введения 5×10 11 инфекционных частиц аденовируса/кг. Снижение количества тромбоцитов на 80-90% измерялось в течение 48 часов [ 62 ] .
В клинических исследованиях также сообщалось о тромбоцитопении после применения аденовирусных векторов для генной терапии. Например, инъекция 10 10 -10 13 аденовирусных частиц, кодирующих ген тимидинкиназы, пациентам с метастатическими опухолями печени показала тромбоцитопению 1 степени у 6 из 16 пациентов (38%) и 3 степени у 1 субъекта (6%) [ 63 ] . В фазе I клинических испытаний, включавших инъекцию 10 12 аденовирусных частиц, экспрессирующих белок теплового шока 70, в раковую ткань, у двух пациентов (7%) развилась тромбоцитопения, причем один случай классифицировался как степень 4 [ 64 ] .
Как частицы аденовируса вызывают образование тромбов и тромбоцитопению, до сих пор плохо изучено. Активированные тромбоциты способствуют свертыванию крови как за счет взаимной агрегации, так и за счет облегчения на своей клеточной поверхности мембранозависимых реакций плазматического каскада свертывания, что в конечном итоге приводит к активации и агрегации фибрина. Было установлено, что активация тромбоцитов происходит быстро после инкубации с аденовирусом человека типа C5 (HAdv-C5) и что тромбоциты экспрессируют рецептор прикрепления HAdv-C5, CAR. Это предполагает, что прямое связывание HAdv-C5 с CAR на тромбоцитах может быть ответственным за опосредованную вирусом активацию тромбоцитов. Это подтверждается некоторыми исследованиями, проведенными in vitro и in vivo [ 65 , 66 ] .. Во-вторых, было также показано, что HAdv-C5 активно связывается с фактором свертывания крови X, что указывает на механизм прямой активации плазматического каскада свертывания с возможными разрушительными последствиями.
В формировании тромба участвуют многочисленные элементы, в том числе эндотелиальные клетки, тромбоциты, белки плазмы и изменения напряжения сдвига. В кровообращении при повреждении стенки сосуда обнажается коллаген, что вызывает накопление тромбоцитов в месте повреждения и их активацию. Это опосредуется фактором фон Виллебранда (VWF), который вызывает прилипание тромбоцитов к стенке поврежденного сосуда посредством связывания как с коллагеном, так и со специфическими рецепторами на поверхности тромбоцитов. Активированные тромбоциты также рекрутируют лейкоциты. Образуются фибрин и фибронектин, которые перекрестно связываются друг с другом, образуя белковую пробку, чтобы остановить кровопотерю.
У мышей с нокаутом von VWF инъекция аденовируса не показала значительной тромбоцитопении по сравнению с мышами дикого типа [ 67 ] . Это исследование также показало, что аденовирус вызывает адгезию тромбоцитов к эндотелиальным клеткам. Затем образование смешанных агрегатов тромбоцитов и лейкоцитов вызывает свертывание крови. Такая неконтролируемая активация и рекрутирование могут привести к тромбозу, повреждению тканей и потере функции органа. Если это происходит одновременно в нескольких местах — состояние, известное как диссеминированное внутрисосудистое свертывание, — оно также потребляет факторы свертывания плазмы и тромбоциты. Результатом будет одновременное диффузное, аберрантное свертывание крови и кровотечение. Отсутствие тромбоцитопении у нокаутных мышей с дефицитом факторов комплемента С3 и В.22 ] также предполагает роль системы комплемента сыворотки в этом явлении.
6.8.4. Свертывание крови, индуцированное аденовирусными переносчиками: клинические наблюдения
Совсем недавнее наблюдение патологического свертывания крови, вызванного вирусным вектором, касается генного терапевтического средства Zolgensma, предназначенного для лечения спинальной мышечной атрофии, редкого генетического заболевания двигательных нейронов. Метод доставки гена, используемый для Zolgensma, по существу такой же, как и для вакцины J & J, только с немного другим вирусом, а именно с нереплицирующимся рекомбинантным аденоассоциированным вирусом серотипа 9. Клиническое применение может вызвать тромботическую микроангопатию [ 68 ]. Это острое и опасное для жизни состояние, характеризующееся тромбоцитопенией, гемолитической анемией и острым повреждением почек. Поскольку эта генная терапия была одобрена для лечения детей со спинальной мышечной атрофией, на сегодняшний день во всем мире было зарегистрировано пять подтвержденных случаев ТМА у примерно 800 детей, получавших лечение.
В целом очевидно, что новый метод введения генетического материала в клетки человека через аденовирусы или аденоассоциированные вирусы чреват опасными побочными эффектами, причины которых пока не совсем ясны. Хотя такие риски могут быть приемлемыми при других неизлечимых состояниях, таких как спинальная мышечная атрофия, абсолютно безответственно возлагать их на здоровых людей, у которых практически нет риска тяжелого течения COVID-19.
6.8.5. Вакцино-индуцированные нарушения свертываемости крови и кровотечения: заключение
В этом разделе будет ясно, что следует ожидать повреждения сосудов, свертывания крови и кровотечения, вызванных вакциной J & J и другими вакцинами против SARS-CoV-2 на основе генов. Однако из перечисленных выше патогенетических механизмов ни один не был изучен, а тем более исключен, J & J в каких-либо доклинических экспериментах на животных. В основном клиническом исследовании численный дисбаланс наблюдался для венозных тромбоэмболических событий у 11 субъектов в группе вакцины (6 случаев тромбоза глубоких вен, 4 случаев легочной эмболии, 1 случая тромбоза поперечного синуса) по сравнению с 4 в группе плацебо. [ 3 ] (стр. 160).
С момента утверждения вакцины J & J у вакцинированных лиц наблюдались многочисленные случаи тромбоэмболических осложнений и ДВС-синдрома (см. Раздел 9 ), что послужило причиной временного прекращения ее использования в 15 странах, многие из которых являются членами ЕС.
6.9. Риск неврологических заболеваний
Помимо общей опасности кровотечения и тромбообразования, которые также относятся к головному мозгу и могут привести к инсульту и тромбозу церебральных венозных синусов, существует множество форм воспалительных и демиелинизирующих заболеваний, включая поперечный миелит, диссеминированный энцефаломиелит, паралич Белла и синдром Гийена. синдром Барре. В то время как все генные вакцины страдают [ 69 , 70 ] , синдром Гийена-Барре был идентифицирован как особый риск при использовании вакцины J&J [ 71 ] .
7. Клинические исследования
Большая часть отчета EMA [ 3 ] посвящена клиническим испытаниям вакцины J&J. Краткое изложение протоколов исследования, разработанных J & J, можно найти на страницах 59-64 отчета. Исследования фазы 3 проводились на международном уровне, но более 40 % участников были из США и еще 40 % из шести латиноамериканских стран [ 3 ] (стр. 103). В Бразилии значительный процент (примерно 30%) участников имел нейтрализующие антитела против аденовируса серотипа 26 еще до вакцинации; примерно 15% этих субъектов не реагировали на вакцину [ 3 ] (стр. 82).
В исследованиях утверждается, что клиническая эффективность вакцины против COVID-19 любой степени тяжести составляет 67%, а против клинически тяжелой формы COVID-19 — 77% [ 3 ] (стр. 139). Кроме того, серьезные побочные эффекты были предположительно редкими, с незначительным «численным дисбалансом» в неблагоприятную сторону вакцины (по сравнению с плацебо) сообщалось о тромбоэмболических явлениях, судорогах, параличе Белла и астме [ 3 ] (стр. 174-5).
Много усилий было затрачено на детальное исследование оптимальной дозы вакцины J&J для человека и необходимого количества доз вакцины. Хотя многие данные, которые должны были быть собраны, не представлены в отчете, представляется, что однократной дозы 5 × 10 10 вирусных частиц достаточно, чтобы вызвать гуморальный и клеточный иммунный ответ у взрослых в возрасте 18–55 лет и 65 лет и старше. . Бустерная доза привела лишь к небольшому увеличению титра антител. Вероятная причина заключается в том, что белки векторного вируса Ad 26 индуцируют родственные антитела после первой инъекции, которые затем нейтрализуют вирусные частицы после второй инъекции (см. раздел 6.5.3 ).). В соответствии с этим объяснением, более чем у 95% реципиентов вакцины действительно выработались антитела к Ad26 после первой инъекции [ 3 ] (стр. 87).
За субъектами наблюдали в среднем всего 58 дней после вакцинации, что, конечно, означает, что продолжительность защиты после восьми недель после вакцинации неизвестна. Короткая продолжительность наблюдения также подрывает достоверность сообщаемой статистики о нежелательных явлениях. Недавнее исследование, проведенное Bansal et al., показало, что шиповидный белок остается обнаруживаемым даже через четыре месяца после вакцинации, что повышает реальную перспективу долгосрочного аутоиммунного заболевания. В то время как субъекты, исследованные Bansal et al. получили вакцину Pfizer, такая же длительная или даже более длительная персистенция должна считаться вероятной при вакцине J & J (см. Раздел 6.6.5).). Еще одним заметным недостатком клинических испытаний является отсутствие данных о безопасности и эффективности для лиц с ослабленной иммунной системой или другими сопутствующими заболеваниями, поскольку это единственная группа, подверженная значительному риску тяжелых последствий COVID-19.
Хотя можно было бы более подробно изучить и подвергнуть критике эти клинические исследования, сейчас это в значительной степени спорно, поскольку за это время накопились убедительные доказательства недостаточной эффективности вакцины J & J в реальных условиях (см. Раздел 8 ) и безопасности (Раздел 9 ). ). Эти данные заменяют и делают недействительными предполагаемые результаты клинических испытаний.
8. Реальная эффективность вакцины Johnson & Johnson отрицательная.
Недавние данные, опубликованные министерством здравоохранения Израиля, показывают, что COVID с одинаковой вероятностью может возникнуть у вакцинированных и непривитых людей, что говорит о том, что истинная эффективность составляет не 95%, а скорее близка к 0%. То же самое видно из отчета Центра по контролю и профилактике заболеваний США, в котором рассматривается кластер инфекций COVID, которые произошли среди вакцинированных и непривитых людей в округе Барнстейбл, штат Массачусетс, в июле 2021 года [ 72 ] . Данные обобщены в таблице 1 .. Две мРНК-вакцины имеют относительный риск заражения около 1, что указывает на отсутствие эффективности. С вакциной J&J относительный риск значительно выше: у реципиентов этой вакцины почти в 2,5 раза больше шансов заболеть COVID-19, чем у населения в целом, и почти в три раза больше, чем у непривитых. Хотя это открытие может показаться неожиданным на первый взгляд, правдоподобным объяснением является антителозависимое усиление болезни (см. Раздел 6.7 ).
| Случаи % (n) | Население % | Относительный риск | |
| непривитый | 26% (123) | 31% | 0,85 |
| вакцина Пфайзер | 34% (159) | 39% | 0,88 |
| Современная вакцина | 28% (131) | 26% | 1,07 |
| Вакцина Джонсон и Джонсон | 12% (56) | 4,8% | 2,47 |
| Любая вакцина | 74% (346) | 69% | 1,07 |
| Госпитализация (любая вакцина) | 80% (4) | — | (1.29) |
Относительный риск госпитализации, связанный с вакциной, указанный в таблице, основан всего на 5 случаях и, следовательно, не является статистически надежным. Однако мы отмечаем, что это небольшое количество госпитализированных случаев указывает на очень низкую тяжесть заболевания в целом. Особый интерес в этой связи заключается в том, что большинство этих случаев, по-видимому, было связано с так называемым дельта-вариантом, который был идентифицирован в 89% из тех 133 случаев, в которых вирусная РНК была охарактеризована с помощью геномного секвенирования.
Браун и др. не указать, был ли вариант Дельта чрезмерно представлен среди «прорывных» случаев, которые произошли у вакцинированных лиц; таким образом, неполные данные, представленные в этом исследовании, не исключают возможности того, что вакцины могли быть более эффективными с исходным уханьским штаммом SARS-CoV-2. Однако, как бы то ни было, РНК-вирусы всегда подвержены антигенному дрейфу. Даже если мы предположим, что вакцины были активны против уханьского штамма, их устаревание из-за антигенного дрейфа в течение нескольких месяцев после введения было бы достаточно, чтобы сделать их бесполезными на практике.
Браун и др. [ 72 ] заявляют, что все зарегистрированные ими случаи были «связаны с массовыми скоплениями людей», что говорит о том, что большинство пострадавших до заражения инфекцией находились в удовлетворительном состоянии. В других исследованиях сообщалось о «прорывных» случаях заражения вакциной как среди здоровых [ 73 ] , так и среди людей с уже существующими неврологическими заболеваниями [ 74 ] . В целом ясно, что вакцины, в том числе вакцина J & J, не работают.
Дополнительные доказательства неэффективности вакцин дает статистический обзор 68 стран, в которых заболеваемость COVID-19 в течение недели до 3 сентября 2021 года коррелировала с уровнем вакцинации населения [ 75 ] . Результаты обобщены на рисунке 2 . Уровень вакцинации колеблется от 0% до 80%; таким образом, если вакцинация действительно может уменьшить распространение болезни, это должно быть видно на графике. Вместо этого мы видим, что заболеваемость COVID-19 на самом деле растет вместе с уровнем вакцинации; но корреляция очень слабая. В целом ясно, что это крупномасштабное сравнение не показывает какого-либо защитного эффекта вакцинации.
9. Безопасность вакцины Johnson & Johnson
С момента внедрения вакцин в реестры по всему миру поступили сообщения о многочисленных побочных эффектах. Здесь мы сосредоточимся на двух регистрах, а именно на системе отчетности о нежелательных явлениях вакцин в США (VAERS) и системе мониторинга нежелательных явлений лекарственных препаратов ЕС (EudraVigilance).
9.1. Общее количество случаев и смертельных исходов, зарегистрированных в EudraVigilance и VAERS
В таблице 2 приведены данные о количестве нежелательных явлений для каждой из четырех вакцин против COVID, развернутых в странах Европейского Союза. Мы видим очень большое количество инцидентов и смертельных случаев по всем направлениям. Pfizer удалось набрать наибольшее количество жертв, потому что их вакцина используется наиболее широко. Вакцина Moderna занимает второе место; он также примечателен высоким процентом зарегистрированных событий со смертельным исходом. В этом отношении Johnson & Johnson лишь немного отстает от Moderna.
| Производитель | Неблагоприятные события | Летальные исходы | Смертельные события |
| Модерна | 112 252 | 6358 | 5,7% |
| Пфайзер | 419 921 | 11 711 | 2,8% |
| АстраЗенека | 370 122 | 5254 | 1,4% |
| Джонсон и Джонсон | 26 833 | 1203 | 4,5% |
| Всего | 929 128 | 24 526 | 2,6% |
Итоговые значения в базе данных VAERS несколько ниже, но все равно ужасно высоки. С помощью VAERS мы также можем получить количество случаев заболевания и летальных исходов по возрастным группам. Эти данные обобщены в таблице 3 отдельно для вакцины J & J и для всех вакцин против COVID вместе взятых (включая J и J). Смертельные исходы возникают во всех возрастных группах, но чаще страдают пожилые люди. Среди лиц в возрасте до 19 лет вакцина J & J еще не привела к летальным исходам, скорее всего, потому, что до сих пор она не очень широко использовалась в этой возрастной группе. В целом, однако, с вакциной J & J уровень летальности от побочных эффектов выше среднего, что напоминает тенденцию, наблюдаемую в EudraVigilance.
Невозможно узнать, какой процент всех смертельных случаев, произошедших вскоре после вакцинации, будет фактически сообщен VAERS или EudraVigilance. Сравнение между различными европейскими странами показывает, что отчетность очень неполная. Например, Исландия и Нидерланды сообщают об одном нежелательном явлении на каждые 112 и 77 инъекций вакцины соответственно, в то время как в Германии это число составляет 534, в Словакии — 8 367, а в Польше — 36 851.
Мы отмечаем, что общее количество смертельных случаев от вакцины против COVID в VAERS уже превышает количество зарегистрированных для всех других вакцин вместе взятых за весь 30-летний период существования этой системы отчетности. Таким образом, ясно, что эти вакцины, несомненно, являются самыми смертоносными в истории — вполне предсказуемо, и все это для болезни, смертность от которой не превышает смертность от гриппа [ 77 ] и ничтожно мала у здоровых людей [ 78 , 79 ] .
| Джонсон и Джонсон | Все | |||||
| Возраст (лет) | Всего событий | Летальные исходы | Смертельно (%) | Всего событий | Летальные исходы | Смертельно (%) |
| 0–9 | 22 | 0 | 0,0 | 1522 | 5 | 0,3 |
| 10–19 | 229 | 0 | 0,0 | 37 959 | 70 | 0,2 |
| 20–29 | 703 | 30 | 4.3 | 82 291 | 195 | 0,2 |
| 30–39 | 10 128 | 46 | 0,5 | 123 359 | 340 | 0,3 |
| 40–49 | 9763 | 80 | 0,8 | 121 121 | 509 | 0,4 |
| 50–59 | 10 735 | 167 | 1,6 | 122 001 | 1070 | 0,9 |
| 60–69 | 7436 | 282 | 3,8 | 112 634 | 2152 | 1,9 |
| 70–79 | 2708 | 210 | 7,8 | 77 212 | 3004 | 3,9 |
| ≥ 80 | 1141 | 213 | 18,7 | 38 815 | 4871 | 12,5 |
| Всего | 42 865 | 1028 | 4.15 | 716 914 | 12 216 | 2.30 |
9.2. Сердечные приступы и миокардит или перикардит по возрастным группам
Принято считать, что при заболевании COVID-19 шиповидный белок вируса запускает поражение сосудов и свертывание крови [ 15 , 81 , 82 ] . Ярким клиническим проявлением свертывания крови является инфаркт миокарда (сердечный приступ). Другой формой поражения сердца, также связанной с шиповидным белком, но чисто воспалительной, а не связанной со свертыванием крови, является миокардит [ 57 ] .
Поскольку все вакцины против COVID индуцируют выработку активного шиповидного белка, следует ожидать, что они также будут вызывать сердечные приступы и миокардит; и на самом деле и VAERS, и EudraVigilance документируют большое количество случаев. На рис . 3А случаи этих заболеваний, зарегистрированные в VAERS, сгруппированы по возрасту. Частота сердечных приступов увеличивается с возрастом, что ожидаемо. Обратите внимание, однако, что даже в самой младшей возрастной группе насчитывается целых 213 случаев; это очень нерегулярно. На панели B того же рисунка зарегистрированные сердечные приступы сгруппированы по времени, прошедшему с момента инъекции вакцины. Из всех зарегистрированных сердечных приступов 49% произошли в течение одного дня после вакцинации, а 84% — в течение одной недели. Эта тесная корреляция во времени очень сильно указывает на причинно-следственную связь с вакциной.
Из панели А видно, что возрастное распределение миокардита/перикардита практически зеркально отражает распределение сердечных приступов — оно самое высокое в самой молодой возрастной группе и постоянно снижается с возрастом. В частности, миокардит сам по себе является очень серьезным заболеванием; это может быть фатальным в острой фазе и, вероятно, оставит после себя некоторое пожизненное функциональное нарушение. Таким образом, в целом все возрастные группы подвержены значительному риску серьезного вреда своему сердечно-сосудистому здоровью от вакцин.
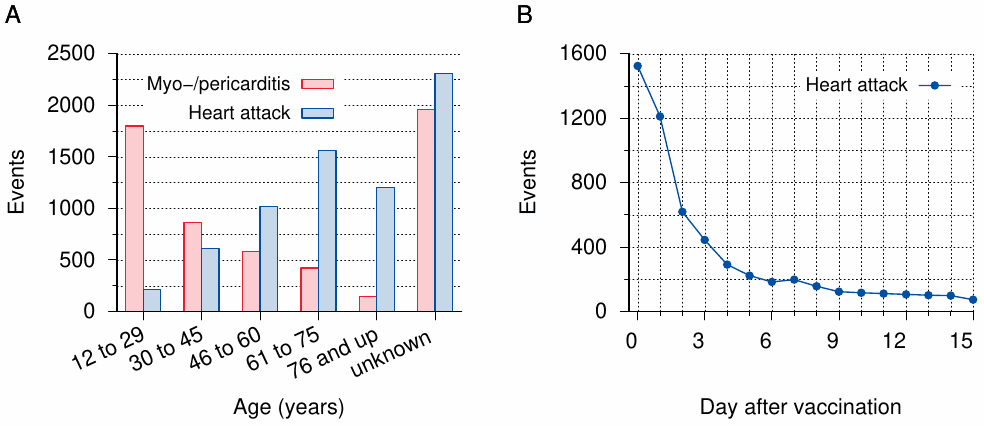
9.3. Другие тяжелые явления, связанные с нарушением свертываемости крови
Помимо инфарктов миокарда, список диагнозов в обеих базах данных, указывающих на патологическую активацию свертывания крови, почти бесконечен — инсульты, тромбозы в головном мозге и других органах, тромбоэмболия легочной артерии; но также тромбоцитопению и кровотечение, которые возникают в результате избыточного потребления тромбоцитов и факторов свертывания крови при ДВС-синдроме. Нарушения свертывания крови вызвали многие из вышеперечисленных смертельных исходов; в других случаях они вызывали тяжелое острое заболевание, которое во многих случаях приводит к тяжелой инвалидности.
9.4. Выкидыши
По состоянию на 3 декабря 2021 г. VAERS содержит 2 437 сообщений о случаях невынашивания беременности среди привитых беременных женщин; из них 92 касаются вакцины J&J. Хотя трудно установить, какой процент этих выкидышей следует отнести на счет вакцинации — Центры по контролю и профилактике заболеваний заявили, что рассмотрели этот вопрос [ 84 ] , но были вынуждены признать с опечатками, что это исследование было полностью испорчено [ 85 ] — мы должны отметить, что о большинстве случаев в VAERS и EudraVigilance сообщили медицинские работники, которые, очевидно, считали связь с вакциной по крайней мере вероятной.
Одно только это большое количество сообщений было бы достаточной причиной, чтобы приостановить вакцинацию и провести расследование. Следует также отметить, что беременные женщины были исключены из клинических испытаний вакцины Moderna, как и других вакцин от COVID. Продолжение вакцинации без надлежащего расследования перед лицом растущих признаков вреда является абсолютно безответственным.
9.5. Другие тяжелые реакции
Тяжелые реакции также включают судороги и другие неврологические симптомы, особенно связанные с моторным контролем, и тяжелое системное воспаление с поражением многих органов. Опять же, у многих из этих пациентов весьма вероятно длительное или даже постоянное остаточное повреждение.
10. Вакцинация против COVID-19 не нужна
Есть несколько доказательств того, что нет необходимости вакцинировать население в целом от COVID-19.
10.1. Летальность от COVID-19 среди населения в целом низкая.
Подавляющее большинство всех инфицированных COVID-19 выздоравливает после легкого, часто нехарактерного заболевания. По данным ведущего мирового эпидемиолога Джона Иоаннидиса [ 86 , 87 ] , уровень летальности от COVID-19 составляет порядка 0,1-0,2% во всех возрастных группах с очень сильным уклоном в сторону пожилых людей, особенно тех, у кого -заболевания. Этот показатель не превышает диапазон, обычно наблюдаемый при гриппе, против которого вакцинация подростков не считается срочной или необходимой.
10.2. COVID-19 имеет особенно низкую распространенность и тяжесть среди подростков.
Обзор Rajapakse et al. [ 88 ] утверждает, что в международном масштабе дети и подростки до 18 лет составляют лишь 1-2% всех подтвержденных клинических случаев COVID, и что тяжесть заболевания в целом была низкой. Также сообщалось, что дети и подростки лишь изредка передают болезнь взрослым, проживающим в одних и тех же домохозяйствах; передача в обратном направлении встречается гораздо чаще [ 89 ] .
В этой возрастной группе самые тяжелые случаи наблюдались среди очень маленьких детей [ 90 ] . Это согласуется с отсутствием у младенцев перекрестного иммунитета к COVID-19, который в других возрастных группах обусловлен предшествующим контактом с обычными респираторными коронавирусами человека (см. Раздел 10.5 ). У детей немного старшего возраста в начале 2020 г. наблюдался своеобразный мультисистемный воспалительный синдром [ 91 ] . Возможно, у этих пациентов также отсутствовал перекрестный иммунитет, хотя также утверждалось, что синдром может иметь постинфекционный иммунный патогенез [ 88 ] .
Основа для общей очень низкой заболеваемости COVID у детей была выяснена в иммунологических исследованиях, о которых сообщили Loske et al. [ 92 ] . По данным этих авторов, слизистые оболочки дыхательных путей у детей обладают более сильным неспецифическим иммунитетом, чем у взрослых; например, рецепторы распознавания образов более сильно выражены у детей. Они также демонстрируют более сильный ответ Т-клеток CD8.
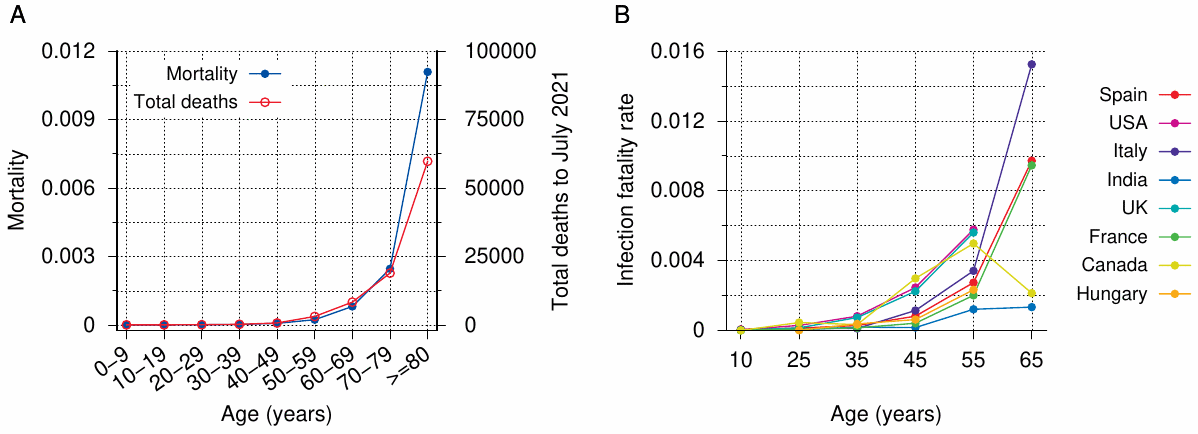
На рисунке 4 сравниваются показатели смертности и летальности от инфекции между возрастными группами. Панель А очень четко показывает, что смертность подростков исчезающе мала; на самом деле смертность в этой возрастной группе ниже, чем во всех других. По состоянию на июль 2021 года Немецкий институт Роберта Коха сообщил о 11 смертельных случаях среди лиц в возрасте от 10 до 19 лет, то есть даже не о двух случаях на миллион. Размышлять о массовой вакцинации экспериментальной вакциной в условиях такой низкой общей смертности нецелесообразно.
10.3. COVID-19 можно лечить
Многочисленные опытные врачи сотрудничали в разработке эффективных руководств по лечению клинически манифестного COVID-19 [ 95 ] .. Доступны варианты лечения как для ранней стадии заболевания, когда упор делается на ингибирование репликации вируса, так и для поздней стадии, при которой первостепенное значение имеет противовоспалительное лечение. Два препарата, которые успешно использовались на ранней стадии, — это гидроксихлорохин и ивермектин. Оба препарата использовались и продолжают использоваться против множества других заболеваний. Ивермектин, например, считается достаточно безопасным, чтобы его можно было использовать не только для лечения манифестной чесотки — неприятного, но нетяжелого паразитарного поражения кожи, вполне поддающегося местному лечению, — но даже в профилактических целях при бессимптомных контактах с чесоткой. инфицированных лиц [ 96 ] .
Ивермектин также широко используется при лечении тропических паразитарных заболеваний, таких как онхоцеркоз (речная слепота), и по этой причине он включен в список основных лекарственных средств ВОЗ. Тем не менее, в связи с COVID-19 ВОЗ считает целесообразным предостеречь от использования этого самого известного и безопасного препарата вне клинических испытаний [ 97 ] . Эта политика не может быть рационально оправдана, и вполне уместно отвергнута национальными или региональными органами здравоохранения и проигнорирована отдельными врачами во всем мире.
Доступность эффективного лечения лишает смысла экстренное использование вакцин для всех без исключения возрастных групп, в том числе и для подростков.
10.4. Большинство людей, особенно подростки, к настоящему времени невосприимчивы к SARS-CoV-2.
Из-за множества врожденных пороков и недостатков широко используемых методов диагностики невозможно точно определить пропорции тех, кто уже был инфицирован SARS-CoV-2, и тех, кто еще не инфицирован. Однако есть признаки того, что доля заразившихся и выздоровевших высока:
- Заболеваемость мультисистемным воспалительным синдромом у детей (см. раздел 10.2 ) достигла пика в начале-середине 2020 г., а затем снизилась с некоторой задержкой после начальной волны самого респираторного заболевания COVID-19 [ 98 ] .
- Приблизительно 60% случайно выбранных испытуемых из Британской Колумбии имеют обнаруживаемые антитела против нескольких белков SARS-CoV-2 (личное сообщение Стивена Пелеха, Университет Британской Колумбии), что указывает на перенесенную инфекцию вирусом, в отличие от вакцинации, которая могла бы вызвать антитела только к одному (спайковому) белку.
Было обнаружено, что перенесенная инфекция COVID-19 очень надежно защищает от повторного заражения [ 99 ] , а сильный специфический гуморальный и клеточный иммунитет выявляется почти у всех выздоровевших лиц, а также у тех, кто оставался бессимптомным на протяжении всей инфекции [ 100 ] . Таким образом, значительная часть лиц во всех возрастных группах, в том числе подростки, уже имеют специфический, надежный иммунитет к COVID-19.
10.5. Перекрестный иммунитет между SARS-CoV-2 и другими коронавирусами
Коронавирусы представляют собой большое семейство оболочечных одноцепочечных РНК-вирусов. У людей и различных видов животных они вызывают инфекции дыхательных путей, степень тяжести которых может варьироваться от легкой до летальной. Однако подавляющее большинство коронавирусных инфекций у людей вызывают легкие заболевания (простуду), хотя у очень маленьких детей, у которых отсутствует иммунитет от предыдущего контакта, респираторные заболевания могут быть более тяжелыми. Такую же клиническую картину вызывают и вирусы из ряда других семейств, преимущественно риновирусы.
Вирус, вызывающий COVID-19, известен как коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2). Хотя утверждается, что SARS-CoV-2 возник естественным образом у одного из видов летучих мышей [ 101 ] , тщательный анализ геномных последовательностей SARS-CoV-2 и родственных штаммов вируса однозначно указывает на то, что вирус на самом деле является искусственным. происхождение [ 102 – 105 ] . Первоначально осуждаемое как «теория заговора», это объяснение недавно и с опозданием получило признание в мейнстриме [ 106 ] .
SARS-CoV-2-реактивные Т-клетки [ 107–109 ] и антитела [ 110 , 111 ] широко распространены даже у тех, кто не подвергался воздействию этого вируса ; это в основном связано с предыдущими инфекциями с другими коронавирусами. Перекрестно-реактивные Т-клетки, которые, вероятно, важны для защиты от инфекции SARS-CoV-2, обнаруживаются даже среди тех, у кого нет обнаруживаемых перекрестно-реактивных антител [ 112 , 113 ] . Защитный эффект такого перекрестного иммунитета был задокументирован [ 114-117 ] .
Перекрестный иммунитет будет особенно эффективен у здоровых подростков и молодых людей. Лица со специфическим иммунитетом или достаточным перекрестным иммунитетом не могут получить никакой пользы от прохождения экспериментальной вакцинации. Скорее наоборот, они подвержены повышенному риску побочных эффектов от этого [ 118 ] .
10.6. Бессимптомная передача COVID-19 не реальна
Часто цитируемое обоснование вакцинации лиц, которые сами не подвержены риску тяжелого заболевания, заключается в необходимости вызвать «коллективный иммунитет»: те немногие, кто подвергается высокому риску, должны быть защищены путем предотвращения распространения вируса среди населения в целом.
Подтекстом этого обоснования является идея «бессимптомного распространения» — предполагается, что люди, которые были инфицированы, но у которых нет никаких признаков этого, кроме положительного теста ПЦР, передают эту инфекцию другим восприимчивым лицам. Если принять идею такого бессимптомного распространения, то профилактическая массовая вакцинация действительно может оказаться единственным средством надежной защиты тех, кто находится в группе риска.
Однако было однозначно установлено, что такой бессимптомной передачи не происходит. В крупномасштабном исследовании, в котором приняли участие почти 10 миллионов жителей Китая, не удалось выявить новых случаев заражения у лиц, у которых был положительный результат теста на SARS-CoV-2 с помощью ПЦР, но у которых не было никаких других признаков инфекции [ 119 ] . Это согласуется с несколькими исследованиями, в которых ПЦР сравнивали с выделением вируса в клеточной культуре у пациентов с острым заболеванием COVID-19. Во всех случаях рост вируса в клеточной культуре прекращался по мере стихания симптомов или вскоре после этого, тогда как ПЦР оставался положительным в течение недель или месяцев после этого [ 120 , 121 ] .. Соответственно было предложено использовать клеточную культуру, а не ПЦР, для оценки инфекционности и определения продолжительности изоляции [ 121 ] .
Эти данные показывают, что ограничение контактов лиц, входящих в группу риска, с теми, у кого проявляются или совсем недавно проявились симптомы острого респираторного заболевания, было бы эффективной и достаточной мерой защиты. Таким образом, для достижения такой защиты не требуется неизбирательной массовой вакцинации лиц, которые сами не подвержены риску тяжелого заболевания.
11. Приложение: краткие биографии авторов
Профессор Сухарит Бхакди, доктор медицинских наук , является почетным профессором медицинской микробиологии и иммунологии и бывшим заведующим Институтом медицинской микробиологии и гигиены Майнцского университета имени Иоганна Гутенберга. Доктор Бхакди провел экспериментальные исследования по многим темам, включая систему комплемента, бактериальные токсины, малярию и атеросклероз.
Майкл Палмер, доктор медицины, адъюнкт-профессор биохимии химического факультета Университета Ватерлоо, Онтарио, Канада. Он получил сертификат совета по медицинской микробиологии и эпидемиологии инфекционных заболеваний в немецкой провинции Ренания-Пфальц во время работы с доктором Сухаритом Бхакди в Университете Майнца, Германия. Его исследования сосредоточены на бактериальных токсинах и липопептидных антибиотиках, а его предметы обучения включают медицинскую микробиологию, метаболизм и фармакологию.
Вольфганг Водарг, доктор медицинских наук , специалист по внутренним болезням легких и бронхов, гигиене и медицине окружающей среды, эпидемиологии и общественному здравоохранению; Почетный член Парламентской ассамблеи Совета Европы и бывший глава Комитета по здравоохранению Парламентской ассамблеи Совета Европы; бывший член немецкого федерального парламента (бундестага); инициатор и представитель исследовательской комиссии «Этика и право в современной медицине»; автор и преподаватель университета.
Примечания
- Разделы 6.8.1 и 6.8.2 были адаптированы из недавней судебной экспертизы вакцины Moderna, проведенной Palmer2021d.
- Вакцины, производимые компаниями Pfizer, Moderna и J & J, включают две замены пролина, предназначенные для стабилизации шиповидного белка в конформации «пре-слияния». Однако это не предотвращает протеолитического высвобождения фрагмента S1, который, по-видимому, отвечает за большую часть прямой токсичности.
использованная литература
- Палмер, М. и др. (2021) Экспертные данные о мРНК-вакцине против COVID-19 для детей Comirnaty (Pfizer) .
- Палмер, М. и Бхакди, С. (2021) Экспертное заключение относительно использования мРНК-вакцины Moderna против COVID-19 у детей .
- Аноним, (2021) Оценочный отчет EMA: вакцина против COVID-19 Janssen .
- Аноним, (2021 г.) Информационный документ FDA: Вакцина Janssen Ad26.COV2.S для профилактики COVID-19 .
- Аноним, (2018) Что такое генная терапия? .
- Anonymous, (2015) Научные принципы оценки регуляторного риска при обнаружении побочного агента в продаваемой вакцине, Приложение 2, TRS № 993 .
- Петриччиани, Дж. и др. (2014) Случайные агенты в вирусных вакцинах: уроки, извлеченные из 4 тематических исследований. Биологические препараты: журнал Международной ассоциации биологической стандартизации 42:223-36
- Бос, Р. и соавт. (2020) Вакцина против COVID-19 на основе вектора Ad26, кодирующая стабилизированный до слияния иммуноген SARS-CoV-2 Spike, вызывает мощные гуморальные и клеточные иммунные ответы. Вакцины NPJ 5:91
- Меркадо, Н.Б. и др. (2020) Одноразовая вакцина Ad26 защищает от SARS-CoV-2 у макак-резусов. Природа 586:583-588
- ван дер Люббе, ДЖЕМ и др. (2021) Ad26.COV2.S защищает сирийских хомяков от остроконечного варианта SARS-CoV-2 G614 и не усиливает респираторное заболевание. Вакцины NPJ 6:39
- Тостаноски, Л.Х. и соавт. (2020) Вакцина Ad26 защищает от тяжелого клинического заболевания SARS-CoV-2 у хомяков. Нац. Мед. 26:1694-1700
- Джагер, Л. и Эрхардт, А. (2009) Персистентность аденовирусных векторов высокой емкости в виде дефектных по репликации мономерных геномов in vitro и в мышиной печени. Гум. Джин Тер. 20:883-96
- Аноним, (2020) Долгосрочное наблюдение после введения продуктов генной терапии человека: руководство для промышленности .
- Летаров А.В. и соавт. (2021) Свободные частицы белка S1 шипа SARS-CoV-2 могут играть роль в патогенезе инфекции COVID-19. Биохимия М. 86:257-261
- Буонвино, С. и Мелино, С. (2020) Новый паттерн консенсуса в Spike CoV-2: потенциальные последствия для процесса коагуляции и слияния клеток. Открытие гибели клеток 6: 134
- Линч, Дж. П. и Каджон, А. Е. (2016) Аденовирус: эпидемиология, глобальное распространение новых серотипов и достижения в лечении и профилактике. Семинары по респираторной и интенсивной терапии 37:586-602
- Эршинг, Дж. и соавт. (2010) Нейтрализующие антитела к аденовирусам человека и обезьян у людей и обезьян Нового Света. Вирусология 407:1-6
- Барух, Д.Х. и соавт. (2011)Международная сероэпидемиология аденовирусов серотипов 5, 26, 35 и 48 у детей и взрослых. Вакцина 29:5203-9
- Меннечет, ФЖД и др. (2019) Обзор распространенности аденовирусов человека за 65 лет. Экспертиза вакцин 18:597-613
- Фаустер-Бовендо, Х. и Кобингер, Г.П. (2014) Существовавший ранее иммунитет против векторов Ad: гуморальный, клеточный и врожденный ответ, что важно?. Hum Vaccin Immunother 10: 2875-84
- Lasaro, MO and Ertl, HCJ (2009) Новые взгляды на аденовирусы как на переносчики вакцин. Мол. тер. 17:1333-9
- Эпплдорн, Д.М. и соавт. (2008) Сложные взаимодействия с несколькими ответвлениями системы комплемента определяют врожденный и гуморальный иммунитет к аденовирусным векторам. Ген Тер 15: 1606-17
- Лерман, С. (1999) Лечение вируса под вопросом после смерти от генной терапии. Природа 401: 517-8
- Рапер, С.Э. и др. (2003)Смертельный системный воспалительный ответный синдром у пациента с дефицитом орнитинтранскарбамилазы после переноса аденовирусного гена. Мол. Жене. Метаб. 80:148-58
- Уилсон, Дж. М. (2009) Уроки, извлеченные из испытания генной терапии дефицита орнитинтранскарбамилазы. Мол. Жене. Метаб. 96:151-7
- Каззола, М. и др. (2021) Споры вокруг вакцины «Спутник V». Респираторная медицина 187:106569
- Стасиак, А.С. и Стеле, Т. (2020) Связывание аденовируса человека с рецепторами клетки-хозяина: структурный взгляд. Мед. микробиол. Иммунол. 209:325-333
- Доерфлер, В. (2021) Вакцины против Covid-19 на основе аденовирусной векторной ДНК и мРНК SARS-CoV-2: возможная интеграция в геном человека – экспрессируются ли аденовирусные гены в векторных вакцинах? Вирус рез. 302:198466
- Митани, К. и Кубо, С. (2002) Аденовирус как интегрирующий вектор. Курс. Джин Тер. 2:135-44
- Мустафа, А. и др. (2017) Виром ДНК крови у 8000 человек. PLoS Патог. 13:e1006292
- Оренд Г. и соавт. (1994) Избирательные сайты интеграции аденовирусной (чужеродной) ДНК в геном хомяка: изменения в паттернах интеграции. Дж. Вирол. 68:187-94
- Стивен С.Л. и соавт. (2010)Хромосомная интеграция ДНК аденовирусного вектора in vivo. Дж. Вирол. 84:9987-94
- Доерфлер В. и соавт. (1995) О встраивании чужеродной ДНК в геномы млекопитающих: механизм и последствия. Бытие 157: 241-5
- Энтер, К. и Добнер, Т. (2004) Трансформация клеток человеческими аденовирусами. Курс. Вверх. микробиол. Иммунол. 273:163-214
- Доерфлер В. (2009) Эпигенетические механизмы онкогенеза аденовируса человека типа 12. Семин. Рак биол. 19:136-43
- Staal, FJT и др. (2008) Sola dosis facit venenum. Лейкемия в испытаниях генной терапии: вопрос о векторах, вставках и дозировке? Лейкемия 22:1849-1852
- Хасейн-Бей-Абина, С. и др. (2008)Инсерционный онкогенез у 4 пациентов после ретровирус-опосредованной генной терапии SCID-X1. Дж. Клин. Вкладывать деньги. 118:3132-42
- Моррал, Н. и др. (1999)Введение хелпер-зависимых аденовирусных векторов и последовательная доставка различных серотипов векторов для долгосрочного переноса генов, направленного на печень, у павианов. проц. Натл. акад. науч. США 96:12816-21
- Tirado, SMC and Yoon, K. (2003) Антителозависимое усиление вирусной инфекции и болезни. Вирусная иммунология 16:69-86
- Ульрих, Х. и др. (2020) Лихорадка денге, COVID-19 (SARS-CoV-2) и антителозависимое усиление (ADE): перспектива. Цитометрия А 97:662-667
- Ценг, С. и др. (2012) Иммунизация вакцинами против коронавируса SARS приводит к легочной иммунопатологии при заражении вирусом SARS. PLoS One 7: e35421
- Йонг, С.И. и соавт. (2019) Последние достижения в разработке вакцины против ближневосточного респираторного синдрома-коронавируса. Фронт. микробиол. 10:1781
- Клотье, М. и др. (2020)ADE и гипервоспаление при инфекции SARS-CoV2 — сравнение с геморрагической лихорадкой денге и инфекционным перитонитом кошек. Цитокин 136:155256
- Клэй, К. и др. (2012)Первичная коронавирусная инфекция тяжелого острого респираторного синдрома ограничивает репликацию, но не воспаление легких при гомологичном повторном вызове. Дж. Вирол. 86:4234-44
- Боллес, М. и др. (2011)Двойная инактивированная вакцина против коронавируса тяжелого острого респираторного синдрома обеспечивает неполную защиту у мышей и вызывает усиленную эозинофильную провоспалительную легочную реакцию при заражении. Дж. Вирол. 85:12201-15
- Ясуи, Ф. и др. (2008) Предварительная иммунизация нуклеокапсидным белком коронавируса, ассоциированного с тяжелым острым респираторным синдромом (ТОРС), вызывает тяжелую пневмонию у мышей, инфицированных ТОРС-КоВ. Дж. Иммунол. 181:6337-48
- Ивата-Йошикава, Н. и соавт. (2014)Влияние стимуляции Toll-подобных рецепторов на эозинофильную инфильтрацию в легких мышей BALB/c, иммунизированных УФ-инактивированной коронавирусной вакциной, связанной с тяжелым острым респираторным синдромом. Дж. Вирол. 88:8597-614
- Хонда-Окубо, Ю. и др. (2015)Вакцины против коронавируса, ассоциированного с тяжелым острым респираторным синдромом, в состав которых входят дельта-инулиновые адъюванты, обеспечивают усиленную защиту при уменьшении эозинофильной иммунопатологии легких. Дж. Вирол. 89:2995-3007
- Чуб М. и соавт. (2005) Оценка рекомбинантной вакцины против SARS на основе модифицированного вируса коровьей оспы Анкара у хорьков. Вакцина 23:2273-9
- Негро, Ф. (2020) Играет ли антителозависимое усиление роль в патогенезе COVID-19?. швейцарский мед. еженедельно. 150:w20249
- Tetro, JA (2020) Получает ли COVID-19 ADE от других коронавирусов? Микробы и инфекции 22:72-73
- Огата, А.Ф. и соавт. (2020) Сверхчувствительное серийное профилирование антигенов и антител SARS-CoV-2 в плазме для понимания прогрессирования заболевания у пациентов с тяжелым течением COVID-19. клин. хим. 66:1562-1572
- Гроббелар, Л.М. и соавт. (2021) Спайковый белок S1 SARS-CoV-2 индуцирует фибрин(оген), устойчивый к фибринолизу: последствия для образования микросгустков при COVID-19. (Неизвестный журнал) (препринт)
- Буждыган Т.П. и соавт. (2020) Спайковый белок SARS-CoV-2 изменяет барьерную функцию в двухмерных статических и трехмерных микрожидкостных моделях гематоэнцефалического барьера человека in vitro. Нейробиол Дис 146:105131
- Рагхаван, С. и др. (2021) Спайковый белок SARS-CoV-2 вызывает деградацию соединительных белков, которые поддерживают целостность эндотелиального барьера. Frontiers Cardiovasc Med 8 (препринт)
- Амраи, Р. и соавт. (2020) CD209L/L-SIGN и CD209/DC-SIGN действуют как рецепторы для SARS-CoV-2 и по-разному экспрессируются в эпителиальных и эндотелиальных клетках легких и почек. bioRxiv (препринт)
- Сирипантонг, Б. и др. (2020) Распознавание миокардита, связанного с COVID-19: возможная патофизиология и предлагаемые рекомендации по диагностике и лечению. Сердечный ритм 17:1463-1471
- Огата, А.Ф. и соавт. (2021) Циркулирующий антиген вакцины против SARS-CoV-2, обнаруженный в плазме реципиентов вакцины с мРНК-1273. клин. Заразить. Дис. (препринт)
- Лафон, А. и др. (1998)Генерация тромбов после опосредованного аденовирусом переноса генов в атеросклеротические артерии. Гум. Джин Тер. 9:2795-800
- Волинс, Н. и др. (2003) Внутривенное введение неспособного к репликации аденовируса макакам-резусам вызывает тромбоцитопению за счет увеличения клиренса тромбоцитов in vivo. бр. Дж. Гематол. 123:903-5
- Шнелл, М.А. и соавт. (2001)Активация врожденного иммунитета у нечеловеческих приматов после внутрипортального введения аденовирусных векторов. Мол. тер. 3:708-22
- Цихон, Г. и др. (1999) Внутривенное введение рекомбинантных аденовирусов вызывает тромбоцитопению, анемию и эритробластоз у кроликов. J Gene Med 1: 360-71
- Сунг, М.В. и др. (2001)Внутриопухолевый перенос суицидального гена, опосредованный аденовирусом, для печеночных метастазов колоректальной аденокарциномы: результаты клинического испытания фазы I. Мол. тер. 4:182-91
- Ли, Дж. и др. (2009)Испытание фазы I по внутриопухолевому введению рекомбинантного онколитического аденовируса, сверхэкспрессирующего HSP70, у пациентов с прогрессирующей солидной опухолью. Гене Тер 16: 376-82
- Шимони, Н. и др. (2009) Анализ прикрепления аденовирусов к тромбоцитам человека. Журнал вирусологии 6:25
- Радди, Н. и др. (2016) Псевдотипирование аденовируса серотипа 5 с помощью волокна из других серотипов раскрывает ключевую роль белка волокна в индуцированной аденовирусом 5 тромбоцитопении. Гум. Джин Тер. 27:193-201
- Отман, М. и др. (2007) Тромбоцитопения, индуцированная аденовирусом: роль фактора фон Виллебранда и P-селектина в обеспечении ускоренного клиренса тромбоцитов. Кровь 109: 2832-9
- Чанд, Д.Х. и соавт. (2021) Тромботическая микроангиопатия после онасемногена абепарвовека при спинальной мышечной атрофии: серия случаев. Дж. Педиатр. 231:265-268
- Гарг Р.К. и Паливал В.К. (2021) Спектр неврологических осложнений после вакцинации против COVID-19. Нейрол. науч. (препринт)
- Исмаил И.И. и Салама С. (2021) Систематический обзор случаев демиелинизации ЦНС после вакцинации против COVID-19. Дж. Нейроиммунол. 362:577765
- Ву, Э.Дж. и др. (2021) Ассоциация получения вакцины Ad26.COV2.S COVID-19 с предполагаемым синдромом Гийена-Барре, февраль-июль 2021 г. JAMA 326:1606-1613
- Браун, К.М. и соавт. (2021) Вспышка инфекций SARS-CoV-2, включая инфекции COVID-19, вызванные прорывом вакцины, связанные с крупными публичными собраниями — округ Барнстейбл, штат Массачусетс, июль 2021 г. MMWR. Еженедельный отчет о заболеваемости и смертности 70:1059-1062
- Бергверк, М. и др. (2021) Прорывные инфекции Covid-19 среди вакцинированных медицинских работников. Н. англ. Дж. Мед. (препринт)
- Санкари, К.М. и др. (2021) Прорывные случаи COVID-19 у вакцинированных ветеранов США с травмами и заболеваниями спинного мозга. Спинной мозг (препринт)
- Субраманиан С.В. и Кумар А. (2021 г.) Рост заболеваемости COVID-19 не связан с уровнями вакцинации в 68 странах и 2947 округах США. Евро. Дж. Эпидемиол. (препринт)
- Шилхави, Б. (2021) 24 526 смертей и 2 317 495 травм в результате прививок от COVID, зарегистрированных в базе данных Европейского союза о побочных реакциях на лекарства .
- Браун, Р.Б. (2020) Уроки общественного здравоохранения, извлеченные из предубеждений в завышении оценок смертности от коронавируса. Медицина катастроф Подготовка общественного здравоохранения. стр. 1-24
- Anonymous, (2020) Report sulle caratteristiche dei pazienti deceduti positivi a COVID-19 in Italia. Il Presente Report è basato sui aggiornati al dati 17 Marzo 2020 .
- Пушель, К. (2020) Судебно-медицинский патологоанатом: никто в Гамбурге не умер от COVID-19 в одиночку .
- Аноним, (2021) OpenVAERS .
- Бисвас, С. и соавт. (2021) Сгустки крови у пациентов с COVID-19: упрощение любопытной тайны.
Мед. Гипотезы 146:110371 - Магро, К.М. и соавт. (2021) Тяжелый COVID-19: синдром многогранной вирусной васкулопатии. Анналы диагностической патологии 50:151645
- Аноним, (2021) OpenVAERS COVID Vaccine Data .
- Симабукуро, Т.Т. и соавт. (2021) Предварительные данные о безопасности вакцины мРНК Covid-19 у беременных. Н. англ. Дж. Мед. 384:2273-2282
- Anonymous, (2021) Опечатка: предварительные данные о безопасности вакцины мРНК Covid-19 у беременных. Н. англ. Дж. Мед. (препринт)
- Иоаннидис, JPA (2020) Коэффициент летальности от инфекции COVID-19, полученный на основе данных о распространенности серотипа. Бык. Всемирный орган здравоохранения. п. БЛТ.20.265892
- Иоаннидис, JPA (2021) Согласование оценок глобального распространения и смертности от COVID-19: обзор систематических оценок. Евро. Дж. Клин. Вкладывать деньги. 5:e133554
- Раджапаксе, Н. и Диксит, Д. (2021) Человеческие и новые коронавирусные инфекции у детей: обзор. Педиатрия и международное детское здоровье 41:36-55
- Галоу, Л. и др. (2021) Более низкие показатели передачи SARS-CoV-2 в домашних условиях от детей по сравнению со взрослыми. Дж. Заразить. 83:е34-е36
- Цабури, С. и др. (2021) Факторы риска тяжести течения коронавирусной болезни у детей, 2019 г.: всесторонний обзор литературы. Педиатрические клиники Северной Америки 68:321-338
- Абрамс, Дж. Я. и соавт. (2020) Мультисистемный воспалительный синдром у детей, связанный с тяжелым острым респираторным синдромом Коронавирус 2: систематический обзор. Дж. Педиатр. 226:45-54
- Лоске, Дж. и соавт. (2021) Предварительно активированный противовирусный врожденный иммунитет в верхних дыхательных путях контролирует раннюю инфекцию SARS-CoV-2 у детей. Природная биотехнология (препринт)
- Anonymous, (2020) Bevölkerung nach Altersgruppen und Geschlecht .
- Axfors, C. and Ioannidis, JP (2021) Уровень летальности от инфекции COVID-19 среди населения, проживающего в сообществе, с акцентом на пожилых людей: обзор. medRxiv (препринт)
- Маккалоу, П.А., и соавт. (2020)Многогранное высокоцелевое последовательное многолекарственное лечение ранней амбулаторной инфекции SARS-CoV-2 высокого риска (COVID-19). Обзоры сердечно-сосудистой медицины 21: 517-530
- Берниго, К. и др. (2021) Пероральный ивермектин при вспышке чесотки в учреждении длительного ухода: потенциальная ценность для предотвращения COVID-19 и связанной с ним смертности. бр. Дж. Дерматол. 184:1207-1209
- Anonymous, (2021) ВОЗ рекомендует использовать ивермектин для лечения COVID-19 только в рамках клинических испытаний .
- Флад, Дж. и др. (2021) Педиатрический мультисистемный воспалительный синдром, временно связанный с SARS-CoV-2 (PIMS-TS): проспективный, национальный эпиднадзор, Великобритания и Ирландия, 2020 г. The Lancet Regional Health. Европа 3:100075
- Шреста, Н.К. и соавт. (2021) Необходимость вакцинации против COVID-19 у ранее инфицированных лиц. medRxiv (препринт)
- Нильсен, С.С. и др. (2021) SARS-CoV-2 вызывает сильные адаптивные иммунные реакции независимо от тяжести заболевания. ЭБиоМедицина 68:103410
- Андерсен, К.Г. и соавт. (2020) Ближайшее происхождение SARS-CoV-2. Нац. Мед. 26:450-452
- Соренсен, Б. и соавт. (2020) Биовак-19: вакцина-кандидат против Covid-19 (SARS-CoV-2), разработанная на основе анализа ее общего метода действия на инфекционность. {QRB} Открытие 1 (препринт)
- Соренсен, Б. и соавт. (2020) Доказательства того, что это не вирус, возникший естественным путем. Препринт (препринт)
- Ян, Л. и др. (2020) Необычные особенности генома SARS-CoV-2, предполагающие сложную лабораторную модификацию, а не естественную эволюцию, и определение его вероятного синтетического пути. Препринт (препринт)
- Ян, Л. и др. (2020) SARS-CoV-2 — неограниченное биологическое оружие: правда, раскрытая в результате раскрытия крупномасштабного организованного научного мошенничества. Препринт (препринт)
- ван Хелден, Дж. и соавт. (2021) Призыв к объективному, открытому и прозрачному научному обсуждению происхождения SARS-CoV-2. Ланцет (препринт)
- Грифони, А. и др. (2020) Цели ответа Т-клеток на коронавирус SARS-CoV-2 у людей с болезнью COVID-19 и лиц, не подвергшихся воздействию. Ячейка 181:1489-1501.e15
- Матеус, Дж. и др. (2020)Селективные и перекрестно-реактивные Т-клеточные эпитопы SARS-CoV-2 у не подвергавшихся воздействию людей. Наука 370:89-94
- Нельде, А. и др. (2020) Пептиды, полученные из SARS-CoV-2, определяют гетерологичное и индуцированное COVID-19 распознавание Т-клеток. Природная иммунология (препринт)
- Мадждуби, А. и соавт. (2021) У большинства неинфицированных взрослых наблюдается ранее существовавшая реактивность антител против SARS-CoV-2. Обзор JCI 6 (препринт)
- Симула, Э.Р. и др. (2020) HCoV-NL63 и SARS-CoV-2 имеют общие эпитопы, распознаваемые по гуморальному ответу в сыворотке людей, собранной до и во время пандемии CoV-2. Микроорганизмы 8:1993
- Браун, Дж. и соавт. (2020) Наличие SARS-CoV-2-реактивных Т-клеток у пациентов с COVID-19 и здоровых доноров. medRxiv (препринт)
- Шмидт, К.Г. и др. (2021) SARS-CoV-2-серонегативные субъекты нацелены на эпитопы CTL в нуклеопротеине SARS-CoV-2, перекрестно реагирующем на коронавирусы простуды. Фронт. Иммунол. 12:627568
- Дугас М. и соавт. (2021) Менее тяжелое течение COVID-19 связано с повышенным уровнем антител к сезонным коронавирусам человека OC43 и HKU1 (HCoV OC43, HCoV HKU1). Int J Infect Dis 105: 304-306
- Дугас М. и соавт. (2021) Отсутствие антител против нуклеокапсидного белка сезонного коронавируса OC43 позволяет выявить пациентов с риском критического течения COVID-19. Дж . Клин Вирол 139: 104847
- Ямагучи, Т. и др. (2021) Иммунитет против сезонного человеческого коронавируса OC43 смягчает фатальное ухудшение течения COVID-19. Int J Infect Dis (препринт)
- Якинуддин, А. (2020) Перекрестный иммунитет между респираторными коронавирусами может ограничивать смертность от COVID-19. Мед. Гипотезы 144:110049
- Матиудакис, А.Г. и соавт. (2021) Самооценка безопасности и реактогенности вакцин против COVID-19 в реальном мире: опрос получателей вакцины. Жизнь 11 (препринт)
- Цао, С. и др. (2020) Скрининг нуклеиновой кислоты SARS-CoV-2 после блокировки почти у десяти миллионов жителей Ухани, Китай. Нац. коммун. 11:5917
- Вельфель, Р. и соавт. (2020) Вирусологическая оценка госпитализированных пациентов с COVID-2019. Природа 581:465-469
- Базиль, К. и соавт. (2020) Клеточная культура SARS-CoV-2 используется для оценки инфекционности и безопасной деизоляции во время COVID-19. клин. Заразить. Дис. (препринт)